Письмо Федеральной службы по надзору в сфере здравоохранения от 28 октября 2015 г. N 01И-1826/15 "О незарегистрированном медицинском изделии"
Федеральная служба по надзору в сфере здравоохранения на основании экспертного заключения ФГБУ "ВНИИИМТ" Росздравнадзора сообщает о выявлении территориальным органом Росздравнадзора по Москве и Московской области в обращении незарегистрированного медицинского изделия:
"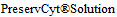 20 ml", REF 70097-003, LOT 3283BA, производства "Hologic Inc.", США, "Hologic (UK) Ltd", Великобритания.
20 ml", REF 70097-003, LOT 3283BA, производства "Hologic Inc.", США, "Hologic (UK) Ltd", Великобритания.
В связи с несоответствием производителя и места производства на выявленное медицинское изделие не распространяется действие регистрационного удостоверения N ФСЗ 2012/11752 от 19.03.2012, срок действия не ограничен, выданного на медицинское изделие "Расходные материалы для подготовки образцов для цитологических исследований на аппаратах ThinPrep 2000 Processor и ThinPrep 5000 Processor, в наборах и отдельных упаковках: флаконы 20 мл с раствором PreservCyt", производства "Hologic Inc.", США.
Федеральная служба по надзору в сфере здравоохранения предлагает субъектам обращения медицинских изделий провести проверку наличия в обращении указанного медицинского изделия, в установленном порядке провести мероприятия по предотвращению обращения на территории Российской Федерации незарегистрированного медицинского изделия и о результатах проинформировать соответствующий территориальный орган Росздравнадзора.
Территориальным органам Росздравнадзора провести мероприятия в соответствии с порядком, предусмотренным Административным регламентом Федеральной службы по надзору в сфере здравоохранения по исполнению государственной функции по контролю за обращением медицинских изделий, утвержденным приказом Минздрава России от 05.04.2013 N 196н.
| Руководитель | М.А. Мурашко |
Обзор документа
Сообщается о выявлении в обращении незарегистрированного медицинского изделия "PreservCyt Solution 20 ml", REF 70097-003, LOT 3283BA, производства "Hologic Inc." (США), "Hologic (UK) Ltd" (Великобритания). В связи с несоответствием производителя и места производства на указанное медизделие не распространяется действие РУ N ФСЗ 2012/11752 от 19.03.2012 (срок действия не ограничен).
Субъектам обращения медицинской продукции предлагается проверить наличие в обращении указанного изделия, провести мероприятия по предотвращению его обращения в России и о результатах проинформировать территориальный орган Росздравнадзора.



(1).jpg)


