Об актуальных изменениях в КС узнаете, став участником программы, разработанной совместно с АО ''СБЕР А". Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.
(1).jpg)
Программа разработана совместно с АО ''СБЕР А". Слушателям, успешно освоившим программу, выдаются удостоверения установленного образца.

Министерство здравоохранения Российской Федерации направляет клинические рекомендации (протокол лечения) "Диагностика и лечение доброкачественных новообразований яичников с позиции профилактики рака", разработанные в соответствии со статьей 76 Федерального закона от 21 ноября 2011 г. N 323-ФЗ "Об основах охраны здоровья граждан в Российской Федерации", для использования в работе руководителями органов исполнительной власти субъектов Российской Федерации в сфере здравоохранения при подготовке нормативных правовых актов, руководителями медицинских организаций акушерско-гинекологического профиля, а также для использования в учебном процессе.
Приложение: на 51 л. в 1 экз.
| С.А. Краевой |
УТВЕРЖДАЮ:
Президент Российского общества
акушеров-гинекологов
академик РАН, профессор
В.Н. Серов
N 15-4/10/2-7838 от 04.12.2018 г.
| АФП | - |

|
|---|---|---|
| ВОЗ | - | Всемирная организация здравоохранения |
| ВТЭО | - | венозные тромботические осложнения |
| ДОЯ | - | доброкачественная опухоль яичников |
| КТ | - | компьютерная томография |
| ЛДГ | - | лактатдегидрогеназа |
| МРТ | - | магнитно-резонансная томография |
| ПЭТ-КТ | - | позитронно-эмиссионная томография |
| РЭА | - | раковый эмбриональный антиген |

|
- | бета-хорионический гонадотропин |
| ЦДК | - | цветовое допплеровское картирование |
| BRCA1/ | - | breast cancer 1/breast cancer 2 - ген рака молочных желез |
| BRCA2 | - | 1/ген рака молочных желез 2 |
| СА 19-9 | - | cancer antigen 19-9 - Углеводный антиген 19-9 |
| СА 72-4 | - | cancer antigen 72-4 - Углеводный антиген 72-4 |
| СА125 | - | cancer antigen 125 - Углеводный антиген 125 |
| IOТА | - | International Ovarian Tumor Analysis - международная группа по анализу опухолей яичников |
| НЕ4 | - | Human epididymis protein 4 - белок эпидидимиса человека 4 |
| RCOG | - | Royal College of Obstetricians and Gynaecologists - Королевская коллегия акушерства и гинекологии (Великобритания) |
| RMI | - | Risk of Malignancy Index - индекс риска злокачественности |
| ROMA | - | Risk of Ovarian Malignancy Algorithm - алгоритм расчета риска аденокарциномы яичников |
Для обозначения патологических изменений ткани яичника используют термин "образование яичников" [9, 16, 23], который включает как кистозные, так и солидные образования.
D27 - доброкачественное новообразование яичников
Опухоли яичников - серьезная проблема среди женщин всех возрастных групп, занимающая 7-ое место (или 4%) в структуре всех злокачественных опухолей у женщин [1]. 5-10% женского населения подвергаются хирургическому лечению по поводу опухолей яичников, причем у 13-21% оперированных обнаруживаются злокачественные опухоли. У беременных частота выявления опухолей придатков матки может достигать 3,2%, а частота злокачественных форм достигает 6,8% от всех опухолей у беременных [9].
Диагностика и дифференциальная диагностика доброкачественных новообразований (опухолей) яичников (ДОЯ) представляет собой важную клиническую задачу с позиций профилактики возможных осложнений, требующих оказания экстренной стационарной квалифицированной медицинской помощи: перекрут придатков матки, апоплексия яичников, нагноение; а также оценки риска злокачественного процесса, диктующего необходимость правильной маршрутизации пациентки.
Отсутствие специфических клинических и диагностических маркеров для пограничных опухолей, латентное течение и низкая выявляемость рака яичников на ранних стадиях, отсутствие специфических и высокочувствительных методов диагностики и лечения приводят к неутешительным результатам выживаемости пациенток этой категории.
Данный протокол ставит цель унифицировать подходы к диагностике и лечению доброкачественных опухолей яичников.
В детском возрасте в 65% наблюдений образования придатков представлены функциональными кистами. Доброкачественные опухоли составляют 28%, из них доминируют зрелые тератомы из группы герминогенных опухолей. Злокачественные опухоли не превышают 8%, и представлены в основном дисгерминомами, опухолями эндодермального синуса, эмбриональными карциномами и незрелыми тератомами [35].
В репродуктивном возрасте большинство новообразований придатков матки представлено доброкачественными опухолями, среди которых преобладают серозная цистаденома и зрелая тератома, и функциональными кистами [37].
В возрасте старше 50 лет одинаково часто встречаются как опухолеподобные образования яичников, так и истинные [18]. Гистологически данные поражения чаще всего относятся к доброкачественным серозным или муцинозным опухолям, доброкачественным опухолям из группы теком-фибром, зрелым тератомам и эндометриоидным кистам.
Распространенность злокачественных опухолей в перименопаузе не превышает 13%, увеличиваясь к периоду постменопаузы до 45% [38]. При этом ранний рак яичников обычно является операционной находкой.
| NB! Постменопаузальный период исключает возможность функциональных кист и эктопической беременности. Объемное образование придатков матки в постменопаузе требует исключения первичного и метастатического рака яичников [6]. |
|---|
Частота опухолей яичников у беременных составляет 0,5-3,4%. При УЗ скрининге в 1 триместре беременности наиболее часто обнаруживаются кисты желтого тела, которые спонтанно регрессируют в течение 2-4 месяцев [14, 43].
С целью снижения заболеваемости и увеличения выживаемости больных злокачественными новообразованиями яичников следует уделять большое внимание тщательной оценке факторов риска у пациенток с объемными образованиями придатков матки, основным из которых является возраст - интегральный фактор риска онкопатологии любой локализации (категория рекомендаций А) [1, 6, 42].
Ввиду нарастания уровня гонадотропинов с возрастом важное значение имеет менопаузальный статус женщины (пременопауза или постменопауза). [49]. Менопаузальный статус используется в расчете как RMI, так и индекса ROMA.
Особой онкологической настороженности требуют пациентки с указанием на злокачественное новообразование любой локализации в анамнезе (категория рекомендаций А) [6], установленными предрасполагающими мутациями BRCA1, BRCA2, Р53, STK11 (синдром Пейтц-Егерса), генов репарации ДНК (синдром Линча - наследственный неполипозный колоректальный рак), RAD51C, DICER и др., а также отягощенным генетическим анамнезом по раку молочных желез, яичников, эндометрия, толстой кишки, желудка, почек, легких [1, 3, 5, 6, 21, 42].
| NB! Показания к медико-генетическому консультированию и генетическому исследованию на носительство предрасполагающих мутаций определяются на основании тщательного анализа генетического анамнеза среди родственников первой линии родства, как по женской, так и мужской линии [1]. |
|---|
Анамнестическое указание на одну родственницу первой линии родства, страдающую раком яичников, увеличивает риск с общепопуляционного 1,4% до 5%; двух родственниц - до 7% (категория рекомендаций В) [1].
Дополнительными факторами, повышающими риск злокачественных новообразований яичников, которые необходимо оценивать и учитывать при выборе лечебно-диагностической тактики в случае выявления объемного образования придатков матки и склоняющими в пользу инвазивной диагностики [1, 42], служат:
- отсутствие беременностей в анамнезе,
- предшествующие стимуляция овуляции,
- эндометриодное поражение яичников в анамнезе,
- односторонняя овариоэктомия в анамнезе,
- раннее менархе и поздняя менопауза (для опухолей I типа по R.J. Kurman),
- позднее менархе и ранняя менопауза (опухолей II типа по R.J. Kurman),
- диета с высоким содержанием жиров и легко усвояемых углеводов,
- ожирение,
- сахарный диабет 2 типа,
- хронический сальпингоофорит (для серозных опухолей),
- асбест.
В качестве факторов, снижающих риск рака яичников, рассматриваются:
- многодетность,
- перенесенная гистерэктомия,
- хирургическая стерилизация или двусторонняя тубэктомия,
- двусторонняя аднексэктомия,
- прием комбинированных оральных контрацептивов (категория рекомендаций А) [1, 3, 5, 6, 21, 42].
- Установленное носительство мутаций, предрасполагающих к наследственному раку яичников: BRCA1, BRCA2, Р53, STK11 (синдром Пейтц-Егерса), генов репарации ДНК (синдром Линча - наследственный неполипозный колоректальный рак), RAD51C. В зарубежной практике при установленном носительстве предрасполагающих мутаций рекомендуется профилактическая двусторонняя овариоэктомия после завершения репродуктивных планов; в случае отказа пациентки - увеличение кратности программы скрининга [1]. В России данный подход не применяется, поскольку не регламентирован порядками и стандартами.
- Отягощенный семейный онкологический анамнез по раку яичников, толстой кишки и молочных желез, свидетельствующий в пользу высокой вероятности носительства предрасполагающих мутаций
- две и более родственницы первой линии родства, как по отношению к пробанду, так и между собой, страдающих раком яичников;
- одна родственница первой линии родства, страдающая раком яичников и вторая родственница первой линии родства, заболевшая раком молочных желез до 50 лет (или родственник, заболевший раком грудных желез), которые также состоят в прямом родстве между собой;
- одна родственница, заболевшая раком яичников в любом возрасте и две родственницы, состоящие в прямом родстве между собой, заболевшие раком молочных желез до 60 лет (для мужчин-родственников - раком грудных желез);
- три и более кровных членов семьи, страдающих колоректальным раком, или два - колоректальным и один - раком желудка, яичников, эндометрия, мочевыделительной системы, тонкой кишки в двух поколениях. У одного из родственников рак должен быть диагностирован до 50 лет, а пораженные члены семьи должны состоять в прямом родстве;
- одна родственница, страдающая первично множественным раком молочных желез и яичников [11].
- ультразвуковые признаки злокачественности в соответствии с рекомендациями ЮТА [46];
- значение индекса риска малигнизации (RMI) 250 и более [10, 11, 16, 50];
- значение индекса ROMA 7, 39% и более в пременопаузе; 25, 29% - в постменопаузе [1, 4, 6].
- Злокачественное новообразование экстраовариальной локализации в анамнезе [1, 11].
- Объемное образование яичников кистозного строения в постменопаузе [11].
- Сочетание двух и более дополнительных факторов риска.
- Общая популяция.
- Женщины без основных и дополнительных факторов риска.
Наиболее актуальной и обоснованной в настоящее время может считаться гистологическая классификация опухолей яичников, принятая ВОЗ в 2014 году с учетом современных представлений о патогенезе опухолей яичника, а также их молекулярно-генетических и биологических особенностей.
В соответствии с данной классификацией выделяют:
1. Опухолеподобные поражения яичников: фолликулярные кисты, кисты желтого тела, лютеомы беременности и др.
2. Опухоли яичников: эпителиальные, мезенхимальные, смешанные эпителиально-мезенхимальные, опухоли полового тяжа и стромы, зародышевоклеточные, смешанные зародышевоклеточные и полового тяжа и стромы, мезотелиальные.
В каждой из групп опухолей яичника выделяют доброкачественные и злокачественные варианты. Среди эпителиальных опухолей яичника также выделяют пограничные опухоли [2].
| NB! Цистаденома яичников - доброкачественная опухоль яичников кистозного строения. |
|---|
| NB! Киста яичников - ретенционное функциональное образование яичников кистозного строения (киста желтого тела или фолликулярная киста). |
Термин "кистома", использовавшийся в отечественной практике ранее, и отсутствующий в научных англоязычных источниках, следует считать анахронизмом.
| NB! Термин "кистома" в настоящее время не используется. |
|---|
Классификация ВОЗ (2014) опухолей яичников основана на их гистологическом строении (см. Приложение Б, таблица 1) [2]. Каждая из морфологических групп подразделяется на доброкачественные и злокачественные варианты. Среди эпителиальных опухолей яичников также охарактеризованы пограничные новообразования.
| NB! Окончательно судить о характере процесса (доброкачественный/злокачественный), и прогнозе заболевания, возможно только после получения результата развернутого морфологического исследования удаленного макропрепарата. |
|---|
Таким образом, особое значение имеет своевременное оперативное лечение пациенток с ДОЯ. Имеющиеся лучевые и лабораторные методы исследования существенно облегчают предварительную диагностику и помогают в маршрутизации больной и разработке хирургической тактики (выбор доступа и объема операции), однако, не позволяют со 100% вероятностью исключить злокачественный рост, в том числе при ультразвуковой картине одностороннего однокамерного кистозного образования яичников без эхографических признаков папиллярных разрастаний.
В соответствии с классификацией ВОЗ (2014), основные нозологические группы сформированы по категориям [3, 21]:
- эпителиальные,
- стромальные,
- мезенхимальные опухоли,
- опухоли стромы полового тяжа,
- герминогенные опухоли,
- смешанные,
- лимфопролиферативные заболевания,
- опухолеподобные заболевания,
- вторичные (метастатические) опухоли.
В зависимости от морфологических признаков атипии клеток и наличия инвазии опухоли яичников подразделены на;
0 - доброкачественная опухоль;
1 - неопределенный потенциал злокачественности или пограничная опухоль;
2 - карцинома in situ, или интраэпителиальная неоплазия III степени;
3 - злокачественная инвазивная опухоль.
Опухоли яичников (доброкачественные и злокачественные) характеризуются длительным бессимптомным течением [1, 4, 6].
| NB! Опухоли яичников в подавляющем большинстве случаев протекают бессимптомно. |
|---|
Клинические симптомы появляются при:
- возникновении осложнений (перекрут ножки опухоли, разрыв, кровоизлияние, нагноение ОЯ) - симптомы "острого живота";
- развитии асцита, гидроторакса в сочетании с наличием яичникового новообразования (описаны как для доброкачественных (синдром Мейгса), так и злокачественных опухолей яичников);
- гормональной активности опухоли (симптомы гиперпродукции тех или иных гормонов):
- андрогенов или эстрогенов при опухолях стромы полового тяжа;
- реже - других гормонов (например, при дисгерминомах, симптомы гипертиреоза при struma ovarii) [6, 42].
| NB! На опухолевую природу гиперандрогении или гиперэстргении указывает резкое нарастание соответствующих гормон-обусловленных симптомов при общем "благополучном" анамнезе. |
|---|
Признаки андроген-продуцирующих опухолей
- развитие вирилизации - исчезновение женских вторичных половых признаков, олиго-/аменорея,
- появление вторичных мужских половых признаков (гирсутизм, перераспределение отложения жировой клетчатки по мужскому типу, огрубение голоса).
Признаки эстроген-продуцирующих опухолей
- преждевременное половое созревание девочек;
- нарушение менструального цикла по типу метроррагии в репродуктивном возрасте;
- развитие гормон-индуцированной гиперплазии эндометрия, эндометриальной интраэпителиальной неоплазии и высокодифференцированного рака эндометрия;
- отсутствие признаков возрастной атрофии наружных и внутренних гениталий в постменопаузе.
| Перечисленные выше симптомы не являются специфичными для ДОЯ или злокачественных новообразований (категория рекомендаций В) [4, 5, 6, 42, 43]. |
|---|
Рак яичников нередко сопровождают неспецифические жалобы, которые могут носить постоянный или частый характер (12 и более в месяц). Следует уделять внимание активному выявлению следующих симптомов [1, 4, 6, 50, 51, 52]:
- увеличение живота, чувство его переполнения или вздутия;
- чувство быстрого насыщения при приеме пищи или потеря аппетита;
- хроническая боль в животе, в том числе нижних отделах;
- учащенное мочеиспускание или ложные позывы к мочеиспусканию.
- Другие симптомы могут включать: кровотечения в постменопаузе; необъяснимая потеря веса; повышенная утомляемость; изменения в работе кишечника.
В настоящее время в мире не существует общепринятого золотого стандарта неинвазивной ранней диагностики, позволяющего идентифицировать злокачественные новообразования яичников на этапе пограничных опухолей и ранних стадий малигнизации. Это связано с рядом причин, в основе которых лежит отсутствие четко обоснованного представления об этиологии и патогенезе РЯ. Учитывая эти пробелы в научных знаниях, ряд требований к эффективному скринингу (ВОЗ) выполняется с поправками и условностями:
1) скрининг должен сосредоточиться на раннем обнаружении инвазивного рака (ввиду отсутствия достаточных знаний о предшествующем поражении - предраке);
2) необходимо учитывать возможный кратчайший временной интервал перехода от I к III стадии (неизвестно, есть ли эволюционное развитие от ранней к поздней стадии или же заболевание изначально возникает как диффузный процесс в брюшной полости);
3) для улучшения прогноза для пациента следует идентифицировать и использовать метод диагностики, позволяющий определить раковую опухоль на столь ранней стадии [34, 35].
| Скрининг рака яичников не рекомендован в общей популяции женщин, а также у женщин без факторов риска (группа низкого риска) (уровень убедительности рекомендаций В) [18]. |
|---|
| Скрининг рака яичников не рекомендуется женщинам, не имеющим симптомов и отягощенной наследственности по раку яичников (уровень убедительности рекомендации D) [52, 53]. |
В группах умеренного риска (злокачественное новообразование экстраовариальной локализации в анамнезе, объемное образование яичников кистозного строения в постменопаузе) [11], начиная с постменопаузы, в качестве первичного скрининга рака яичников рекомендовано ежегодное определение СА 125 сыворотки крови в сочетании с трансвагинальной эхографией органов малого таза в дополнение к общему и специальному гинекологическому осмотру [1, 11, 18, 44].
| NB! Стойкие нерегрессирующие кисты яичников следует пересматривать через 3 месяца, а затем на выборочной основе каждые 6 месяцев [1]. Рекомендуется проводить ежегодные трансвагинальные УЗИ в течение 3 лет и СА 125 в течение 5 лет с момента постановки диагноза (Американский колледж акушерства и гинекологии (ACOG)) [1]. |
|---|
Данные рекомендации связаны с тем, что простые однокамерные кисты яичников распространены в постменопаузе, имеют низкий злокачественный потенциал и, вероятно, останутся стабильными или самостоятельно регрессируют без хирургического вмешательства.
| NB! Увеличение размера кисты или повышение уровня СА 125 должно побудить врача рассмотреть возможность хирургического лечения [1]. |
|---|
Пациенткам группы высокого риска наследственного рака яичников рекомендуется трансвагинальная эхография органов малого таза и определение СА 125 каждые 6 месяцев, начиная с 30 лет или за 5-10 лет до наименьшего возраста дебюта рака яичников у родственницы. Двусторонней аднексэктомии (синоним - билатеральная сальпинго-оофорэктомия) отдается предпочтение, как ввиду снижения риска рака яичников на 80-95%, так и уменьшения риска рака молочных желез в пременопаузе на 50%. Двусторонняя аднексэктомия не снижает риск первичного перитонеального рака (около 4%) (категория рекомендаций В) [1].
Для определения группы высокого риска ненаследственного рака яичников могут использоваться прогностические модели IOТА, RMI и ROMA (категория рекомендаций В) [1, 4, 6, 46-48].
| NB! Высокий риск рака яичников в соответствии с одной или несколькими указанными прогностическими моделями указывают на необходимость консультации онколога и маршрутизации пациентки в стационар онкологического профиля (категория рекомендаций В) [4, 6, 11, 46-48]. |
|---|
| NB! Совокупность клинико-лабораторных и эхографических данных с учетом умеренного риска злокачественного процесса в соответствии с избранной прогностической моделью, свидетельствующая в пользу ДОЯ, позволяет маршрутизировать пациентку в гинекологический стационар (категория рекомендаций В) [4, 6, 11, 46-48]. |
В настоящее время продолжается поиск более эффективных скрининговых программ по выявлению злокачественных опухолей яичников ранних стадий, так как комбинация эхографии органов малого таза и определения СА 125 сыворотки крови признаны неэффективным скринингом ранних стадий рака яичников (категория рекомендаций В) [1], и не снижают смертность от рака яичников [18].
| NB! Трансвагинальная эхография выявляет объемное образование придатков матки (клинический синдром), который требует дальнейшего дифференциально-диагностического поиска [1, 51, 52, 53]. |
|---|
Около 50% аденокарциномы яичников ранних стадий являются СА 125 негативными.
| NB! Нормативные значения СА 125 (менее 35 МЕ/мл) не исключают наличие рака яичников [1, 51, 52]. |
|---|
Ключевыми этапами обследования и диагностики образований яичника являются:
- Сбор анамнеза - подробный сбор семейного анамнеза для исключения злокачественной патологии является весьма важным, так как в настоящее время эффективных скрининговых программ для выявления рака яичников не разработано [14].
- Осмотр в зеркалах, бимануальное ректовагинальное исследование.
- Бимануальное ректовагинальное обследование позволяет определить размеры опухоли, консистенцию, подвижность, консистенцию опухолевых масс, исследовать дугласово пространство, заднюю поверхность прямой кишки, параметрий и т.д. Однако у пациенток с ИМТ более 30  имеет ограничение к применению (уровень доказательности II) [11].
имеет ограничение к применению (уровень доказательности II) [11].
- УЗИ органов малого таза.
- Трансвагинальное УЗИ должно использоваться на первичном этапе обследования всех возрастных групп пациенток, при больших размерах опухоли трансвагинальное УЗИ должно быть дополнено трансабдоминальным УЗИ (категория рекомендаций А) (уровень доказательности II) [10, 11].
International Ovarian Tumor Analysis (IOTA) Group на основании проведенных рандомизированных исследований разработало ультразвуковые критерии ("В-правило" для доброкачественных опухолей и "М-правило" для опухолей с малигнизацией), чувствительность и специфичность которых достигают 95% и 91% соответственно. Система расчета IOTA Group также является высокоэффективной (уровень доказательности I) [3] (таблица 2).
Таблица 2
| УЗ-признаки доброкачественных опухолей | УЗ-признаки злокачественных опухолей |
|---|---|
| Однокамерная киста | Участки солидного компонента |
| Размеры солидного компонента <7 мм | Асцит |
| Наличие акустических теней | Не менее 4 папиллярных структур |
| Гладкостенная многокамерная опухоль диаметром <100 мм | Многокамерная опухоль с множественными солидными компонентами размерами >100 мм |
| Отсутствие кровотока при ЦДК | Сильно выраженный кровоток при ЦДК |
| NB! Отсутствие положительной динамики в размерах образования яичников кистозного строения при контрольном ультразвуковом исследовании спустя 4-6 недель наблюдения позволяет установить предварительный клинический диагноз "опухоль яичников" и прибегнуть к углубленному обследованию пациентки для предварительного уточнения характера роста (доброкачественный/злокачественный) и исключения его метастатического поражения (категория рекомендаций В) [6]. |
|---|
| NB! Детский (до начала полового созревания) и постменопаузальный возраст больной позволяет сразу расценить объемное образование яичника кистозного строения как органическую (нефункциональную) патологию (категория рекомендаций В) [6]. |
Доморфологическая дифференциальная диагностика доброкачественной и злокачественной опухоли яичников проводится на основании трансвагинальной эхографии и определения онкомаркеров сыворотки крови СА 125 (расчет индекса RMI), или эхографии и совокупного определения СА 125 и НЕ4 с подсчетом индекса ROMA (категория рекомендаций В) [6, 11, 47, 48].
Большинство биохимических маркеров являются опухоль-ассоциированными, т.е. неспецифическими. Их уровни повышаются лишь при значительном объеме опухолевых масс, распространении процесса, в то время как на ранних стадиях их концентрация обычно не превышает пороговые показатели. Поэтому, для первичной диагностики их использование ограничено.
У беременных женщин могут быть повышены уровни опухолевых маркеров  , АФП, СА 15-3, SCC и СА125 [33].
, АФП, СА 15-3, SCC и СА125 [33].
СА 125 - маркер злокачественных эпителиальных опухолей яичников и эпителиальных опухолей другой локализации (кишечника, легких, поджелудочной железы, молочной железы).
| NB! СА 125 не используется как скрининговый маркер (категория рекомендаций А), так как может повышаться при беременности, эндометриозе, остром панкреатите, циррозе печени, хронических заболеваниях почек, аппендиците, пневмонии, туберкулезе (уровень рекомендаций II) [10, 11]. |
|---|
Повышение СА 125 до 35 МЕ/мл и выше обнаруживается у 78-100% больных раком яичника (в основном при серозной форме). СА 125 более >65 МЕ/мл выявляется у 50% женщин с первичным раком яичников в перименопаузе и у 98% - в постменопаузе (категория рекомендаций А) [11]. СА 125 коррелирует с величиной опухолевых масс, нормализуясь после радикальной операции и химиотерапии, и повышаясь при рецидиве заболевания. Успешно используется как маркер эффективности химиотерапии, для прогнозирования рецидивов, прогноза выживаемости [19].
В качестве дополнительного маркера наилучшие результаты были получены в отношении. НЕ4, который более чувствителен и специфичен, чем СА 125 для диагностики рака яичников (73% против 43,3% и 95% против 76,4% соответственно) (уровень рекомендаций II). Однако он повышается при эндометриозе и может быть ложноположительным при доброкачественных опухолях (уровень доказательности II) [11, 28].
Онкомаркерами, специфичными для герминогенных опухолей яичника, являются:
- хорионический гонадотропин - уровень более 10 000 нг/мл свидетельствует о распространенности процесса, плохом прогнозе и наличии в опухоли элементов хориокарциномы;
- альфа-фетопротеин - патогномоничен для герминогенных опухолей, особенно для опухолей желточного мешка (эндодермального синуса). Уровень более 1 000 нг/л свидетельствует о плохом прогнозе;
- лактатдегидрогеназа - специфичный маркер для чистой дисгерминомы (повышается практически в 100% случаев).
В настоящее время не доказана польза рутинного исследования дополнительных онкомаркеров: ракового эмбрионального антигена (РЭА), СА 72-4, СА 19-9, 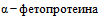 (АФП), лактатдегидрогеназы (ЛДГ) и бета-хорионического гонадотропина (
(АФП), лактатдегидрогеназы (ЛДГ) и бета-хорионического гонадотропина ( ) (категория рекомендаций В) [11].
) (категория рекомендаций В) [11].
- Расчет IRM (индекс риска малигнизации) должен быть базовой методикой, т.к. его чувствительность и специфичность достигают 70-78% и 87-90% соответственно (категория рекомендаций А) [33], в то время как чувствительность и специфичность определения только уровня СА 125 у пациенток в пери- и постменопаузе не превышает 78% (уровень рекомендаций II). IRM основан на возрасте женщины, данных УЗИ, уровне СА 125. По каждому показателю начисляются баллы (таблица 3). Все баллы и уровень СА 125 умножаются. В норме IRM не превышает 200. Повышение его выше 200 является предиктором развития рака яичников (категория рекомендаций А). Чувствительность и специфичность данного метода оценки риска малигнизации составляют 78% и 87% соответственно (категория рекомендаций А) [10, 11].
Таблица 3
| Признак | Балльная система | Пример | |
|---|---|---|---|
| Менопауза | Пременопауза | 1 балл | |
| Постменопауза | 3 балла | 3 | |
| УЗИ данные | Многокамерное | Нет ни одного признака = 0 баллов 1 признак = 1 балл 2-5 признаков = 3 балла | 1 + 1 + 1 = 3 |
| Солидный компонент | |||
| Двухсторонние | |||
| Асцит | |||
| Метастазы | |||
| СА 125 | Абсолютное значение | 90 | |
| ИРМ = (УЗИ данные) * (менопаузальные данные) * СА-125 | 3 * 3 * 90 = 810 | ||
| NB! Вероятные эхографические признаки злокачественного роста и/или повышенные значения указанных онкомаркеров/индексов, требуют обязательной консультации онколога для осуществления рациональной маршрутизации больной, а также расширения диагностического поиска (категория рекомендаций В) [4, 11]. |
|---|
| NB! Расширенный диагностический поиск подразумевает исключение экстраовариальных злокачественных новообразований, часто метастазирующих в яичники: рака желудка, толстой кишки, молочных желез, эндометрия (категория рекомендаций В) [1-6,42]. |
Компьютерная томография (КТ), магнитно-резонансная томография (МРТ) и позитронно-эмиссионная томография (ПЭТ-КТ) не рекомендованы для первичного обследования, направленного на выявление опухолей яичников (категория рекомендаций В [9,113], категория рекомендаций С) [10]), однако, при подозрении на злокачественную опухоль рекомендовано проведение КТ брюшной полости и грудной клетки с контрастированием и МРТ брюшной полости с контрастированием (категория рекомендаций В) [11].
МРТ с контрастированием улучшает доморфологическую диагностику рака яичников в большей степени, чем КТ, эхография с ЦДК или МРТ без контрастирования (категория рекомендаций В) и показана [11]:
- для уточнения анатомических взаимоотношений исследуемых структур, характера роста опухоли, асцита;
- пациенткам, у которых эхография органов малого таза оказалась неинформативной.
| NB! Консультация онколога показана пациенткам при: - выявлении предрасполагающих мутаций наследственного рака яичников [1]; - высоком риске наследственного рака яичников, согласно сбору семейного анамнеза [9, 11]; - высоком риске рака яичников согласно прогностической модели IOTA, RMI, ROMA (категория рекомендаций В) [1, 4, 6, 11, 45-48, 50]; - неподвижных опухолевых массах в малом тазу или билатеральных опухолевых массах плотной или узловатой консистенции у пациенток в постменопаузе (категория достоверности В) [9, 11]; - асците (категория рекомендаций В) [9, 11]; - подозрении на регионарные или отдаленные метастазы [9, 11]. |
|---|
Пункция образования яичника кистозного строения не рекомендована за исключением пациенток с распространенной формой рака яичников при невозможности хирургического лечения для определения гистотипа опухоли перед химиотерапией (категория рекомендаций В) [11]. Аспирационная биопсия содержимого опухоли малоинформативна, ее чувствительность для дифференциальной диагностики доброкачественных и злокачественных новообразований яичников не превышает 25% (уровень доказательности I) и категорически не рекомендована при ультразвуковых признаках малигнизации в целях сохранения абластичности (категория рекомендаций В) [11].
При диагностической лапароскопии может быть взята биопсия только солидной опухоли со срочным интраоперационным морфологическим исследованием и цитологическим исследованием перитонеальной жидкости. Также рекомендовано интраоперационное цитологическое исследование смывов или отпечатков с брюшины (категория рекомендаций В) [19].
Опухоль больших размеров, потенциально нарушающая пассаж мочи и функцию мочевого пузыря, требует исключения обструкции мочевых путей - ультразвукового исследования органов мочевыделительной системы (почек, мочевого пузыря). Выявленные отклонения должны быть интерпретированы урологом.
Тактика ведения и лечения пациенток с доброкачественными опухолями яичников в детском возрасте отражена в приложении Б, раздел 6 [4, 5, 6].
В репродуктивном периоде и пременопаузе дифференциальная диагностика функциональных кист яичников и цистаденом осуществляется посредством назначения повторного эхографического исследования органов малого таза через 4-6 недель (см. приложение Б, раздел 7) [6]. Положительная динамика (исчезновение образования яичника кистозного строения или уменьшение его в размерах) свидетельствуют в пользу отсутствия опухоли яичников.
NB! Назначение комбинированных оральных контрацептивов не ускоряет регресс функциональных кист яичников (категория рекомендаций А) [10].
NB! Аспирация содержимого кисты в качестве лечебного метода вагинальным или лапароскопическим доступом ассоциирована с высоким риском рецидива кисты яичника (категория рекомендаций В) [10].
Подозрение на злокачественный рост, возникшее на основании анализа клинических, лабораторных и эхографических данных (высокий риск злокачественного процесса) требует консультации онколога, который определяет дальнейшую маршрутизацию пациентки.
| NB! В случае отсутствия показаний для госпитализации в стационар онкологического профиля, установленных онкологом, пациентка может быть госпитализирована в стационар гинекологического профиля. |
|---|
| NB! Методом лечения опухолей яичников является хирургический. |
В репродуктивном периоде (18-44 года) предпочтение отдается эндоскопическому доступу (лапароскопии) и органопластическому объему операции (резекция яичников или цистэктомия).
| NB! Лапароскопический доступ является методом выбора для ДОЯ без клинических, лабораторных и эхографических признаков малигнизации (категория рекомендаций А) [10]. |
|---|
Однако при наличии солидного компонента, в ряде случаев, целесообразно рассмотреть лапаротомный доступ (категория рекомендаций С) [10]. При отсутствии условий (локализация, размер опухоли) возможно выполнение односторонней овариоэктомии или односторонней аднексэктомии (синоним - сальпингоовариоэктомия) на стороне поражения. Интраоперационно проводят пункцию опухоли с помощью аспирационной системы со строгим соблюдением правил абластичности и минимальным лаважом с последующим эндоскопическим осмотром внутренней поверхности капсулы.
| NB! Серозный характер содержимого и отсутствие папиллярного компонента являются основанием для отказа от интраоперационного цитологического исследования перитонеальной жидкости, биопсии контрлатерального яичника и резекции большого сальника (категория рекомендаций В) [32]. |
|---|
| NB! Малейшие сомнения, возникающие при макроскопической оценке опухоли, являются показанием для срочного цитологического исследования перитонеальной жидкости, перитонеальных смывов и гистологического исследования опухоли [32]. |
Удаление макропрепарата во время лапароскопии должно проводиться в эндоскопическом контейнере через пупочный троакар или влагалищный свод [10], морцелляция макропрепарата не допускается [4].
Наличие имплантов на брюшине свидетельствует в пользу пограничной или злокачественной опухоли, однако, выполнение радикального объема операции (пангистерэктомии, резекции большого сальника (англ. - infracolicomentectomy) у женщин репродуктивного возраста рационально проводить при наличии данных развернутого морфологического исследования (морфологической верификации диагноза), подтверждающего рак яичников, так как срочная гистологическая диагностика на замороженных срезах фрагментов опухоли не обладает 100% чувствительностью (категория рекомендаций В). Чувствительность и прогностическая значимость срочного гистологического исследования фрагментов опухолей яичников составляет 71,1% и 84,3% соответственно; гипердиагностика отмечена в 6,6%, гиподиагностика в 30,6% наблюдений [4].
| NB! В репродуктивном возрасте объемом оперативного лечения при подозрении на пограничную опухоль яичников или ранний рак яичников является аднексэктомия, резекция контрлатерального яичника, резекция большого сальника, биопсия имплантов, сопровождающиеся аспирацией перитонеальной жидкости и перитонеальными смывами из всех этажей брюшной полости с полным стадированием опухоли (категория рекомендаций В) [36]. |
|---|
При подозрении на малигнизацию опухоли пункционная биопсия опухоли не допускается [32]. У 15% пациенток с серозными опухолями стадии Iа при проведении односторонней аднексэктомии в дальнейшем развивается пограничная опухоль второго яичника [36]. Цистэктомия без оофорэктомии проводится в исключительных случаях у пациенток с I стадией опухоли при возможности ее полного радикального удаления [36].
При операциях по поводу муцинозных цистаденом яичников необходимо помнить о возможности метастазирования высокодифференцированной муцинозной аденокарциномы аппендикса в яичники. Первичная опухоль аппендикса ввиду малых размеров может быть не диагностирована на дооперационном этапе.
| NB! Муцинозная цистоаденома яичников требует проведения срочного гистологического исследования опухоли для решения вопроса о выполнении аппендэктомии [5]. |
|---|
Перед оперативным вмешательством по поводу ДОЯ пациентка репродуктивного возраста должна быть обязательно информирована о возможной аднексэктомии с резекцией контрлатерального яичника [35].
| NB! Оптимальным объемом хирургического лечения пациенток пременопаузального и постменопаузального возраста с опухолью яичников низкого риска (ДОЯ), согласно совокупной оценке анамнестических, эхографических, лабораторных и интраоперационных макроскопических характеристик является двусторонняя аднексэктомия (двусторонняя сальпингоофорэктомия) [10, 11]. |
|---|
| NB! Оптимальным объемом хирургического лечения пациенток пременопаузального и постменопаузального возраста с опухолью яичников умеренного и высокого риска, согласно совокупной оценке анамнестических, эхографических, лабораторных и интраоперационных макроскопических характеристик является пангистерэктомия, резекция большого сальника, интраоперационное стадирование процесса [19, 21, 36]. |
Ретроперитонеальная лимфодиссекция (удаления блоком лимфоузлов, начиная от стенок таза до уровня почечных вен) не является стандартным элементом хирургического лечения женщин с подозрением на рак яичников и вероятным интраоперационным стадированием I (заболевание ограничено яичниками) (категория рекомендаций В) [50].
Врачи должны быть осведомлены о возможности развития и значении кист яичников у женщины в постменопаузе (GPP, хорошая клиническая практика) [11].
У женщин в постменопаузе, имеющих острую боль в животе, следует исключать диагноз осложненной опухоли яичника (например, перекрут, разрыв кисты, кровоизлияние) (GPP, хорошая клиническая практика) [11].
| NB! У постменопаузальных женщин с впервые выявленными объемными образованиями яичников кистозного строения первоначально необходимо определить содержание СА 125 в крови и провести трансвагинальную эхографию органов малого таза (уровень убедительности рекомендаций А) [11]. |
|---|
Роль анамнеза и клинического обследования у женщин в постменопаузе с кистами яичников
Необходимо тщательно собрать анамнез жизни и болезни женщины, обратив особое внимание на факторы риска (см. "Группы риска"), неспецифические симптомы рака яичников, семейный анамнез рака яичников, кишечника или молочной железы (уровень убедительности рекомендаций D) [11].
При наличии отягощенного семейного анамнеза, пациентке следует предложить пройти генетическое исследование (GPP, хорошая клиническая практика) [11].
Соответствующие обследования должны проводиться всем женщинам в постменопаузе, которые в течение последних 12 месяцев отмечают неспецифические симптомы (раздраженного кишечника, диспепсии и др., указанных выше), особенно пациенткам старше 50 лет, с отягощенным семейным анамнезом рака яичников, кишечника или молочной железы (уровень убедительности рекомендаций С) [11].
Физикальное обследование женщины имеет важное значение и должно включать: оценку индекса массы тела, исследование живота для выявления асцита и пальпируемых в яичниках образований, вагинальное обследование (уровень убедительности рекомендаций С) [11].
Уровень СА 125 сыворотки крови не является специфическим тестом и критерием злокачественности опухоли, его нормальное значение не исключает рак яичников! Этот маркер используется только в совокупности с другими показателями для расчета индекса риска малигнизации (RMI) кисты яичников у женщин в постменопаузе (уровень убедительности рекомендаций В) [11].
В настоящее время нет достаточных доказательств в поддержку рутинного клинического использования других онкомаркеров, таких как НЕ4, РЭА, CDX2, СА72-4, СА-19-9, АФП, ЛДГ или бета-ХГЧ, для оценки риска развития злокачественных новообразований яичника в постменопаузе (уровень убедительности рекомендаций В) [11].
Трансвагинальное УЗИ органов малого таза является единственным наиболее эффективным способом оценки кисты яичников в постменопаузе (уровень убедительности рекомендаций А) [11].
Трансабдоминальное УЗИ не следует использовать изолированно! Оно должно дополнить информацию по трансвагинальному УЗИ, особенно когда киста яичника большая или находится за пределами поля зрения трансвагинального УЗИ (уровень убедительности рекомендаций А) [11].
При трансвагинальном сканировании должно быть особенно четко документировано описание структуры образования в яичнике, чтобы произвести расчет риска злокачественности образования (уровень убедительности рекомендаций А) [11].
Трансвагинальное УЗИ должно проводиться с использованием многочастотных зондов квалифицированными врачами, имеющими знания и опыт проведения исследований гинекологических пациенток (уровень убедительности рекомендаций С) [11].
Цветовые допплеровские исследования не рекомендуются для рутинной первоначальной оценки кист яичников в постменопаузе (уровень убедительности рекомендаций С) [11].
Спектральные и импульсные индексы допплера не повышают точность дифференциальной диагностики доброкачественных и злокачественных кист яичников по сравнению с оценкой структуры с помощью УЗИ (уровень убедительности рекомендаций В) [11].
Не рекомендуется рутинное применение трехмерного УЗИ, поскольку не улучшает диагностику кист яичника в постменопаузе (уровень убедительности рекомендаций В) [11].
КТ, МРТ и позитронно-эмиссионная томография (ПЭТ) - КТ сканирование не рекомендуются для первичной оценки кист яичников в постменопаузе из-за низкой специфичности и лучевой нагрузки (уровень убедительности рекомендаций В) [11].
Если злокачественное заболевание заподозрено по клинической картине, УЗИ и онкомаркерам, необходимо выполнить КТ брюшной полости и малого таза с последующей оценкой многопрофильной командой специалистов (уровень убедительности рекомендаций В) [11].
МРТ следует использовать в качестве метода визуализации второй линии, если характеристики кисты яичников при УЗИ неопределенны и неубедительны (уровень убедительности рекомендаций В) [11].
ПЭТ-КТ сканирование не имеет явных преимуществ перед трансвагинальным УЗИ (уровень убедительности рекомендаций С) [11].
- Расчет индекса риска малигнизации (RMI) - широко используемый, наиболее доступный и проверенный эффективный метод отбора женщин с подозрением на рак яичников (уровень убедительности рекомендаций А) [11].
Прогноз вероятности рака яичников по RMI I: при пороге 200 - чувствительность 78%, специфичность 87%; при пороге 250 чувствительность ниже - 70%, но специфичность более высокая - 90% (уровень убедительности рекомендаций А) [11].
КТ брюшной полости и органов малого таза следует проводить всем женщинам в постменопаузе с кистами яичников с величиной  , с последующим направлением к гинекологам-онкологам (уровень убедительности рекомендаций В) [11].
, с последующим направлением к гинекологам-онкологам (уровень убедительности рекомендаций В) [11].
- Ультразвуковые признаки злокачественности в соответствии с рекомендациями международной системы анализа IOTA [46] являются альтернативным методом для дифференциальной диагностики доброкачественных и злокачественных опухолей яичников (уровень убедительности рекомендаций А) [11].
1. Оценить, есть ли показания к хирургическому лечению.
2. Бессимптомные, простые, односторонние, однокамерные кисты яичников диаметром менее 5 см имеют низкий риск злокачественной опухоли. При нормальных уровнях СА 125 сыворотки крови тактика ведения консервативная, с повторным обследованием через 4-6 месяцев. Если через 1 год киста остается неизменной или уменьшается в размере, уровень СА 125 нормальный, возможно наблюдение 1 раз в год, однако следует принять во внимание пожелания пациентки и степень хирургического риска (уровень убедительности рекомендаций D) [11].
3. Если у женщины имеются симптомы заболевания, подозрительное или сложное образование в придатках необходимо дальнейшее хирургическое обследование (GPP, хорошая клиническая практика) [11].
4. Аспирация не рекомендуется для лечения кист яичников у женщин в постменопаузе, за исключением купирования симптомов, когда имеется высокий операционный риск (уровень убедительности рекомендаций В) [11].
5. Лапароскопия
- Лапароскопия может быть выполнена женщинам с RMI I менее 200 (т.е. с низким риском малигнизации) (уровень убедительности рекомендаций В) [11].
- Лапароскопическое лечение кисты яичников у женщин в постменопаузе должен проводить хирург с соответствующим опытом (GPP, хорошая клиническая практика) [11].
- При лапароскопическом вмешательстве по поводу кист яичников у женщин в постменопаузе должна быть выполнена сальпинг-оофорэктомия, а не цистэктомия (уровень убедительности рекомендаций С) [11].
- Женщины, подвергающиеся лапароскопической сальпинг-оофорэктомии, должны быть проинформированы, что может потребоваться лапаротомия, если будет выявлено злокачественное образование (GPP, хорошая клиническая практика) [11].
- Удаленный макропрепарат, по возможности, следует извлекать без вскрытия, поместив в контейнер и удалив через пуповинный порт. Это приводит к уменьшению времени извлечения и послеоперационной боли по сравнению с использованием боковых разрезов того же размера. Трансвагинальное извлечение образца также приемлемо, если хирург имеет соответствующий доступ (уровень убедительности рекомендаций В) [11].
6. Лапаротомия
- У женщин в постменопаузе показана лапаротомия при всех кистах яичников с подозрением на малигнизацию, на что указывает RMI I  200, результаты КТ, клиническая оценка или результаты лапароскопии (уровень убедительности рекомендаций D) [11].
200, результаты КТ, клиническая оценка или результаты лапароскопии (уровень убедительности рекомендаций D) [11].
- Если при лапароскопии или последующей гистологии обнаруживается злокачественное новообразование, женщине показано направление в онкологический центр для дальнейшего лечения (GPP, хорошая клиническая практика) [11].
| NB! Стадирование опухоли осуществляется при: - макроскопическом подозрении на малигнизацию опухоли (т.е. пограничных и злокачественных опухолях яичников); - наличии асцита; - подтверждении морфологического диагноза злокачественной опухоли при интраоперационном гистологическом исследовании [19]. |
|---|
Выделяют следующие этапы интраоперационного стадирования [19]:
1. В операционную должен быть вызван онколог (при его наличии в штате).
2. Проведение срочного гистологического исследования.
3. При асците - аспирация асцитической жидкости для цитологического исследования. При отсутствии асцита выполняют цитологическое исследование мазков/смывов с брюшины (в том числе с ее диафрагмальной поверхности, латеральных каналов и малого таза).
4. Все отделы брюшной полости, включая поддиафрагмальное пространство, сальник, тонкую и толстую кишку и их брыжейку, поверхность париетальной и висцеральной брюшины, забрюшинное пространство, тщательно и методично осматривают, все подозрительные участки подвергают биопсии. Вся поверхность брюшины должна быть осмотрена. Спаечный процесс, препятствующий ревизии, должен быть отмечен.
5. Если проведенный осмотр не подтвердил наличие метастазов, выборочно выполняют биопсию неизмененной брюшины боковых поверхностей малого таза, прямокишечно-маточного углубления, мочевого пузыря, латеральных каналов, а также правого и левого куполов диафрагмы.
6. Резекция большого сальника.
7. Удаление аппендикса - при муцинозном раке и в случае подозрения на его поражение.
Частота встречаемости ДОЯ во время беременности составляет 2% [14]. Большинство из этих образований обнаруживаются в течение первого триместра и представляют собой функциональные кисты, которые самостоятельно регрессируют во втором триместре беременности. У беременных спонтанно регрессируют около 80-95% кист яичников размерами <6 см в диаметре [14].
Ведение пациенток с объемными образованиями придатков матки, выявленными в I триместре, определяется клинико-анамнестическими и эхографическими данными. Наиболее часто эти яичниковые образования кистозного строения в I триместре представлены кистой желтого тела, которая регрессирует самостоятельно. При отсутствии положительной динамики диагностируется опухоль яичников, которая в большинстве случаев является зрелой тератомой или серозной цистаденомой (уровень убедительности рекомендаций В) [25]. ОЯ, персистирующие на протяжении беременности, чаще всего являются функциональными кистами с очень низкой частотой озлокачествления или зрелыми кистозными тератомами с частотой малигнизации от 2% до 6% [14].
УЗИ является безопасным и приемлемым методом для диагностирования причин острой абдоминальной боли у беременных (уровень убедительности рекомендаций А) [13, 14]. В зависимости от срока гестации, в ряде случаев целесообразно проведение абдоминального УЗИ в виду смещения опухоли за пределы малого таза беременной маткой. При необходимости и по показаниям, на основании решения консилиума врачей, могут быть использованы КТ и MPT без контрастирования (уровень убедительности рекомендаций С) [13, 14].
Исследования уровня СА 125 нецелесообразны, т.к. его уровень повышен на протяжении всей беременности (уровень убедительности рекомендаций В) [33, 34].
Лечебная тактика при ДОЯ, диагностированной во время беременности, определяется ее сроком и наличием/отсутствием клинических симптомов.
Частота осложнений (перекрут придатков матки; разрыв, нарушение питания, нагноение опухоли) во время беременности не превышает 2%. Однако необходимо учитывать, что опухоль яичников может служить причиной механического препятствия в родах [7, 43].
Лапароскопия - предпочтительный (уровень убедительности рекомендаций А), безопасный и эффективный метод лечения пациенток с симптомными ДОЯ, который приемлем при условии, что при ультразвуке не выявлено признаков злокачественных новообразований [14].
Данный вид оперативного вмешательства у беременных должен выполняться опытным врачом в учреждении 3-го уровня. В периоперационном периоде необходимо проводить мониторинг сердцебиения плода (уровень убедительности рекомендаций С) [14]. Оперативное вмешательство при беременности может осложнять ее последующее течение. Однако, исходы беременности после планового хирургического лечения ДОЯ, лучше, чем выполненного в экстренном порядке в связи с развитием осложнений (уровень убедительности рекомендаций С) [8].
Опасения по поводу злокачественного потенциала и рисков, связанных с экстренной хирургией, привели к плановому удалению опухолей яичников, которые сохраняются после 16 недель и размерами >6 см в диаметре (уровень убедительности рекомендаций А) [14, 25, 43]. Последние публикации подтверждают безопасность наблюдения таких пациенток, если при УЗИ нет признаков малигнизации, и заболевание протекает бессимптомно [14, 43].
Показания к лапароскопической операции у беременных с ДОЯ [43]:
- отсутствие признаков малигнизации;
- размеры опухоли не более 10-12 см;
- двусторонняя локализация опухолей;
- подвижные опухоли с высоким риском перекрута придатков матки во время и после родов;
- высокий риск разрыва капсулы опухоли по мере прогрессирования беременности при неподвижных опухолях.
Противопоказания к лапароскопии при ДОЯ во время беременности
Абсолютные
- большие размеры опухоли (более 12 см);
- срок беременности более 18 недель;
- признаки малигнизации.
Относительные
- ожирение III-IV степени;
- спаечный процесс в брюшной полости и малом тазу.
Техника операции
Вход в брюшную полость может быть выполнен как открытым доступом, так и с помощью иглы Вереша, или непосредственно оптическим троакаром под визуальным контролем (уровень убедительности рекомендаций С) [14]. Инсуффляция проводится газом  под давлением 10-15 мм рт. ст. предпочтительно не более 12 мм рт. ст.) (уровень убедительности рекомендаций С) [14]. Объем оперативного лечения обычно включает энуклеацию кисты, овариоэктомию или аднексэктомию.
под давлением 10-15 мм рт. ст. предпочтительно не более 12 мм рт. ст.) (уровень убедительности рекомендаций С) [14]. Объем оперативного лечения обычно включает энуклеацию кисты, овариоэктомию или аднексэктомию.
Послеоперационный период
У беременных необходима интра- и послеоперационная пневмокомпрессия ног для профилактики венозных тромботических осложнений в послеоперационный период (категория достоверности С) [14]. Фармакологическая профилактика ВТЭО назначается на основании оценки индивидуального риска в соответствии с действующими клиническими рекомендациями и порядками оказания медицинской помощи. Послеоперационный период должен вестись совместно с акушером (категория достоверности А) [14]. При возникновении угрозы прерывания беременности в сроки до 22 недель или преждевременных родов проводится лечение, соответственно порядкам оказания медицинской помощи и соответствующим клиническим рекомендациям.
Женщинам, планирующим беременность, необходимо посетить врача акушера-гинеколога, сделать УЗИ органов малого таза и при выявлении опухоли яичника провести лечение до наступления беременности [43].
Критерии качества специализированной медицинской помощи взрослым при доброкачественном новообразовании яичника (код по МКБ-10: D27) [54]
|
N п/п |
Критерии качества | Оценка выполнения |
|---|---|---|
| 1. | Выполнен осмотр врачом акушером-гинекологом не позднее 1 часа от момента поступления в стационар (при симптомах острого живота) | Да/Нет |
| 2. | Выполнен общий (клинический) анализ крови развернутый не позднее 2 часов от момента поступления в стационар (при симптомах острого живота) | Да/Нет |
| 3. | Выполнено исследование уровня хорионического гонадотропина человека (бета-субъединица) в крови не позднее 1 часа от момента поступления в стационар (при симптомах острого живота) | Да/Нет |
| 4. | Выполнено ультразвуковое исследование матки и придатков трансвагинальное не позднее 1 часа от момента поступления в стационар (при симптомах острого живота) | Да/Нет |
| 5. | Проведена профилактика инфекционных осложнений антибактериальными лекарственными препаратами за 30 минут до хирургического вмешательства (при отсутствии медицинских противопоказаний) | Да/Нет |
| 6. | Проведена консервативная терапия и/или хирургическое вмешательство (в зависимости от медицинских показаний и при отсутствии медицинских противопоказаний) | Да/Нет |
| 7. | Выполнено морфологическое (гистологическое) исследование препарата иссеченной ткани (при хирургическом вмешательстве) | Да/Нет |
| 8. | Отсутствие тромбоэмболических осложнений в период госпитализации | Да/Нет |
| 9. | Отсутствие гнойно-септических осложнений в период госпитализации | Да/Нет |
Временные критерии качества
- Проведение скрининга рака яичников пациенткам группы риска (да/нет).
- Ежегодное диспансерное наблюдение женщин с доброкачественными заболеваниями яичников (да/нет).
Результативные критерии качества
Отсутствие прогрессии доброкачественных ОЯ в рак яичников.
Приложение А1
Адамян Лейла Владимировна - заместитель директора ФГБУ "Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова" Минздрава России, главный внештатный акушер-гинеколог Минздрава России, академик РАН, профессор. Конфликт интересов отсутствует.
Андреева Елена Николаевна - заместитель директора ФГБУ "Национальный медицинский исследовательский центр эндокринологии" Минздрава России - директор института репродуктивной медицины, профессор кафедры эндокринологии Института высшего и постдипломного образования ФГБУ "Национальный медицинский исследовательский центр эндокринологии" Минздрава России, профессор кафедры репродуктивной медицины и хирургии ФГБОУ ВО "Московский государственный медико-стоматологический университет имени А.И. Евдокимова" Минздрава России, доктор медицинских наук;
Артымук Наталья Владимировна - заведующая кафедрой акушерства и гинекологии N 2 ФГБОУ ВО "Кемеровский государственный медицинский университет" Минздрава России, д.м.н., профессор, главный внештатный специалист Минздрава России по акушерству и гинекологии в Сибирском федеральном округе, член правления Российского общества акушеров-гинекологов, президент КРОО "Ассоциация акушеров-гинекологов Кузбасса";
Асатурова Александра Вячеславовна - старший научный сотрудник патологоанатомического отделения ФГБУ "Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова" Минздрава России, кандидат медицинских наук;
Ашрафян Лев Андреевич - заместитель директора ФГБУ "Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова" Минздрава России - директор института онкогинекологии и маммологии, академик РАН, доктор медицинских наук, профессор;
Белокриницкая Татьяна Евгеньевна - заведующая кафедрой акушерства и гинекологии ФПК и ППС ФГБОУ ВО "Читинская государственная медицинская академия" Минздрава России, д.м.н., профессор, заслуженный врач Российской Федерации, член Правления Российского общества акушеров-гинекологов, Член совета Ассоциации акушерских анестезиологов-реаниматологов, президент Забайкальского общества акушеров-гинекологов;
Долгушина Наталия Витальевна - руководитель службы научно-организационного обеспечения ФГБУ "Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова" Минздрава России, доктор медицинских наук, доцент;
Жордания Кирилл Иосифович - профессор ФГБУ "Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина" Минздрава России, председатель Общества специалистов онкологов по опухолям органов репродуктивной системы, профессор кафедры репродуктивной медицины и хирургии ФППОВ ФГБОУ ВО "Московский государственный медико-стоматологический университет имени А.И. Евдокимова" Минздрава России, академик РАН, доктор медицинских наук, профессор;
Смольнова Татьяна Юрьевна - доцент кафедры репродуктивной медицины и хирургии ФППОВ ФГБОУ ВО "Московский государственный медико-стоматологический университет имени А.И. Евдокимова" Минздрава России; старший научный сотрудник ФГБУ "Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии имени академика В.И. Кулакова" Минздрава России, доктор медицинских наук;
Станоевич Ирина Васильевна - заведующая отделением оперативной# Института высшего и постдипломного образования ФГБУ "Национальный медицинский исследовательский центр эндокринологии" Минздрава России, доктор медицинских наук, доцент;
Филиппов Олег Семенович - заслуженный врач Российской Федерации, доктор медицинских наук, профессор, заместитель директора Департамента медицинской помощи детям и службы родовспоможения Минздрава России, профессор кафедры акушерства и гинекологии ФППОВ ФГБОУ ВО "Московский государственный медико-стоматологический университет имени А.И. Евдокимова" Минздрава России.
Приложение А2
Методы, использованные для сбора/селекции доказательств:
поиск в электронных базах данных
Описание методов, использованных для сбора/селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в электронные библиотеки, базы данных (например, MEDLINE, Pubmed и др.).
Глубина поиска составила 20 лет.
Методы, использованные для оценки качества и силы доказательств:
Консенсус экспертов
Оценка значимости в соответствии с рейтинговой схемой (см. таблицы).
| Уровень доказательности | Характеристика доказательной базы |
|---|---|
| I | Доказательства, полученные в результате мета-анализа большого числа хорошо сбалансированных рандомизированных исследований. Рандомизированные исследования с низким уровнем ложноположительных и ложнонегативных ошибок. |
| II | Доказательства основаны на результатах не менее одного хорошо сбалансированного рандомизированного исследования. Рандомизированные исследования с высоким уровнем ложноположительных и ложнонегативных ошибок. |
| III | Доказательства основаны на результатах хорошо спланированных нерандомизированных исследований. Контролируемые исследования с одной группой больных, исследования с группой исторического контроля и т.д. |
| IV | Доказательства, полученные в результате нерандомизированных исследований. Непрямые сравнительные, описательно корреляционные исследования и исследования клинических случаев. |
| V | Доказательства основаны на клинических случаях и примерах. |
Таблица 2
| Уровень убедительности рекомендаций | Уровень доказательности |
|---|---|
| А | Доказательство I уровня или устойчивые многочисленные данные II, III или IV уровня доказательности. |
| В | Доказательства II, III или IV уровня, считающиеся в целом устойчивыми данными. |
| С | Доказательства II, III или IV уровня, но данные в целом неустойчивые. |
| D | Слабые или несистематические экспериментальные доказательства. |
Методы, использованные для анализа доказательств:
1. Обзоры опубликованных мета-анализов;
2. Систематические обзоры.
Описание методов, использованных для анализа доказательств:
При отборе публикаций, как потенциальных источников доказательств, использованная в каждом исследовании методология изучается для того, чтобы убедиться в ее валидности. Результат изучения влияет на уровень доказательств публикации, что в свою очередь влияет на силу вытекающих из нее рекомендаций.
Приложение Б
| а. Эпителиальные опухоли | ||
|---|---|---|
| 1.2.# Серозные опухоли | ||
| Доброкачественные: | ||
| серозная цистаденома | ||
| серозная цистаденофиброма | ||
| серозная поверхностная папиллома | ||
| Пограничные: | ||
| серозная пограничная опухоль/атипическая пролиферирующая серозная опухоль | ||
| серозная пограничная опухоль - микропапиллярный вариант/неинвазивная высокодифференцированная серозная карцинома | ||
| Злокачественные: | ||
| высокодифференцированная серозная карцинома | ||
| низкодифференцированная серозная карцинома | ||
| 1.2. Муцинозные опухоли | ||
| Доброкачественные: | ||
| муцинозная цистаденома | ||
| муцинозная аденофиброма | ||
| Пограничные: | ||
| муцинозная пограничная опухоль/атипическая пролиферирующая муцинозная опухоль | ||
| Злокачественные: | ||
| муцинозная карцинома | ||
| 1.3. Эндометриоидные опухоли | ||
| Доброкачественные: | ||
| эндометриоидная киста | ||
| эндометриоидная цистаденома | ||
| эндометриоидная аденофиброма | ||
| Пограничные: | ||
| эндометриоидная пограничная опухоль/атипическая пролиферирующая эндометриоидная пограничная опухоль | ||
| Злокачественные: | ||
| эндометриоидная карцинома | ||
| 1.4. Светлоклеточные опухоли | ||
| Доброкачественные: | ||
| светлоклеточная цистаденома | ||
| светлоклеточная аденофиброма | ||
| Пограничные: | ||
| пограничная светлоклеточная опухоль/атипическая пролиферирующая светлоклеточная опухоль | ||
| Злокачественные: | ||
| светлоклеточная карцинома | ||
| 1.5. Опухоли Бреннера | ||
| Доброкачественные: | ||
| опухоль Бреннера | ||
| Пограничные: | ||
| пограничная опухоль Бреннера/атипическая пролиферирующая опухоль Бреннера | ||
| Злокачественные: | ||
| злокачественная опухоль Бреннера | ||
| 1.6. Серомуцинозные опухоли | ||
| Доброкачественные: | ||
| серомуцинозная цистаденома | ||
| серомуцинозная цистаденофиброма | ||
| Пограничные: | ||
| пограничная серомуцинозная опухоль/атипическая пролиферирующая серомуцинозная опухоль | ||
| Злокачественные: | ||
| серомуцинозная карцинома | ||
| 1.7. Недифференцированная карцинома | ||
| b. Мезенхимальные опухоли | ||
| высокодифференцированная эндометриальная стромальная саркома | ||
| низкодифференцированная эндометриальная стромальная саркома | ||
| 2.1. Смешанные эпителиальные и мезенхимальные опухоли | ||
| аденосаркома | ||
| карциносаркома | ||
| 3. Опухоли стромы полового тяжа | ||
| 3.1. Чистые стромальные опухоли | ||
| фиброма | ||
| клеточная фиброма | ||
| текома | ||
| текома с лютеинизацией, ассоциированная со склерозирующим перитонитом | ||
| фибросаркома | ||
| склерозирующая стромальная опухоль | ||
| перстневидно-клеточная стромальная опухоль | ||
| микрокистозная стромальная опухоль | ||
| опухоль из клеток Лейдига | ||
| стероидоклеточная опухоль | ||
| злокачественная стероидоклеточная опухоль | ||
| 3.2. Чистые опухоли из клеток полового тяжа | ||
| гранулезоклеточная опухоль взрослого типа | ||
| гранулезоклеточная опухоль ювенильного типа | ||
| опухоль из клеток Сертоли | ||
| опухоль из клеток полового тяжа с трубчатыми структурами | ||
| 3.3. Смешанные опухоли из клеток и стромы полового тяжа | ||
| 3.3.1 Опухоли из группы Сертоли-Лейдига | ||
| высокодифференцированные | ||
| умеренно дифференцированные | ||
| - с гетерологичными элементами | ||
| низкодифференцированные | ||
| - с гетерологичными элементами | ||
| ретиформные | ||
| - с гетерологичными элементами | ||
| Опухоли стромы полового тяжа, не классифицируемые | ||
| 4. Герминогенные опухоли | ||
| дисгерминома | ||
| опухоль желточного мешка | ||
| эмбриональный рак | ||
| негестационная хориокарцинома | ||
| зрелая тератома | ||
| незрелая тератома | ||
| смешанная герминогенная опухоль | ||
| 5. Монодермальная тератома и органоидные опухоли, формирующиеся из дермоидных кист | ||
| Струма яичника, доброкачественная | ||
| Струма яичника, злокачественная | ||
| Карциноид | ||
| струма-карциноид | ||
| муцинозный карциноид | ||
| Опухоли нейроэктодермального типа | ||
| Опухоли сальных желез | ||
| аденома сальных желез | ||
| карцинома сальных желез | ||
| Другие редкие монодермальные тератомы | ||
| Карциномы | ||
| плоскоклеточная карцинома | ||
| другие | ||
| 6. Смешанные герминогенные опухоли и опухоли из клеток стромы полового тяжа | ||
| гонадобластома, включающая гонадобластому со злокачественными герминогенными клетками | ||
| смешанная опухоль из герминогенных клеток и клеток стромы полового тяжа, неклассифицируемая | ||
| 7. Прочие опухоли | ||
| опухоли сети яичника | ||
| аденома сети яичника | ||
| аденокарцинома сети яичника | ||
| опухоль из клеток Вольфова протока | ||
| мелкоклеточная карцинома, гиперкальциемический тип | ||
| мелкоклеточная карцинома, легочный тип | ||
| опухоль Вильмса | ||
| параганглиома | ||
| солидная псевдопапиллярная опухоль | ||
| 8. Мезотелиальные опухоли | ||
| аденоматоидная опухоль | ||
| мезотелиома | ||
| 9. Мягкотканные опухоли | ||
| миксома | ||
| другие | ||
| 10. Опухолеподобные состояния | ||
| фолликулярная киста | ||
| киста желтого тела | ||
| крупная солитарная лютеинизирующая фолликулярная киста | ||
| гиперреактивная лютеинизация | ||
| лютеома беременности | ||
| стромальная гиперплазия | ||
| стромальный гипертекоз | ||
| фиброматоз | ||
| массивный отек | ||
| гиперплазия клеток Лейдига | ||
| Другие | ||
| 11. Лимфоидные и миелоидные опухоли | ||
| лимфомы | ||
| плазмоцитомы | ||
| миелоидные опухоли | ||
| 12. Вторичные опухоли | ||
| TNM | FIGO | Характеристика стадии |
|---|---|---|
| Т1 | I | Опухоль ограничена яичниками. |
| Т1а | IA | Опухоль ограничена одним яичником, капсула не повреждена, нет опухолевых разрастаний на поверхности яичника, нет злокачественных клеток в асцитической жидкости или смывах из брюшной полости. |
| T1b | IB | Опухоль ограничена двумя яичниками, их капсулы не повреждены, нет опухолевых разрастаний на поверхности яичников, нет злокачественных клеток в асцитической жидкости или смывах из брюшной полости. |
| T1c | IC | Опухоль ограничена одним или двумя яичниками и сопровождается любым из следующих факторов: |
| T1c1 | IC1 | повреждение капсулы во время операции; |
| Т1с2 | IC2 | повреждение капсулы до операции или опухоль на поверхности яичника/маточной трубы. |
| Т1с3 | IC3 | Злокачественные клетки в асцитической жидкости или смывах из брюшины. |
| Т2 | II | Опухоль поражает один или два яичника с распространением на малый таз. |
| Т2а | IIА | Врастание и/или метастазирование в матку и/или одну или обе маточные трубы. |
| Т2b | IIB | Распространение на другие ткани таза. |
| Т3 и/или N1 | III | Опухоль поражает один или оба яичника с гистологически подтвержденными внутрибрюшинными метастазами за пределами таза и/или метастазами в регионарных лимфатических узлах (внутренних, наружных и общих подвздошных, запирательных, крестцовых, поясничных или паховых лимфоузлах). |
| N1 | IIIА1 | Метастазы только в забрюшинных лимфатических узлах. |
| IIIAl(i) | Метастазы в лимфатических узлах размерами до 10 мм. | |
| IIIA(ii) | Метастазы в лимфатических узлах размерами более 10 мм. | |
| Т3а | IIIA2 | Микроскопические, гистологически подтвержденные внутрибрюшинные метастазы за пределами таза с/без метастазов в забрюшинных лимфатических узлах. |
| Т3b | IIIB | Макроскопические внутрибрюшинные метастазы за пределами таза до 2 см включительно в наибольшем измерении с/без метастазов в забрюшинных лимфатических узлах. |
| Т3с | IIIC | Внутрибрюшинные метастазы за пределами таза более 2 см в наибольшем измерении с/без метастазов в забрюшинных лимфатических узлах (включая распространение опухоли на капсулу печени и селезенки без поражения паренхимы органов). |
| M1 | IV | Отдаленные метастазы (исключая внутрибрюшинные метастазы). |
| IVA | Плевральный выпот со злокачественными клетками | |
| IVB | Метастазы в паренхиматозных органах и других органах вне брюшной полости (в том числе паховых лимфатических узлах и лимфатических узлах за пределами брюшной полости). |
| Орган | Кистозное образование | Солидное образование |
|---|---|---|
| Яичник | Функциональная киста Доброкачественная опухоль кистозного строения Пограничная опухоль кистозного строения Злокачественная опухоль кистозного строения Эндометриома (эндометриодная киста) | Доброкачественная опухоль Злокачественная опухоль |
| Маточная труба | Тубовариальный абсцесс Сактосальпингс Параовариальная киста | Тубовариальный абсцесс Эктопическая беременность Опухоль (доброкачественная/злокачественная) |
| Матка | Маточная беременность в двурогой матке или рудиментарном роге | Субсерозная миома матки с интралигаментарным расположением узла |
| Толстая кишка | Сигмовидная или слепая кишка, растянутая газами | Дивертикулит Илеит Аппендицит Колоректальный рак |
| Другие | Растянутый мочевой пузырь Тазовая дистопия почки Киста мочевого протока Серозоцеле | Гематома/абсцесс брюшной стенки Неорганная забрюшинная опухоль |
Для подсчета RMI используются значение СА 125 сыворотки крови (СА 125), менопаузальный статус (М) и ультразвуковые характеристики в баллах (U).
RMI является произведением СА125 (IU/ml), М и U: RMI = СА 125 х M x U
- Значение СА 125 может варьировать от 0 до сотен или тысяч единиц (IU/ml).
- Менопаузальный статус равен 1 в пременопаузе;
Менопаузальный статус равен 3 в постменопаузе.
К постменопаузальным относят женщин с отсутствием менструаций более 1 года или женщин старше 50 лет, перенесших ранее гистерэктомию.
- Значение U определяется путем подсчета баллов при выявлении ниже перечисленных эхографических характеристик:
- многокамерное кистозное образование - 1 балл;
- двусторонний характер поражения - 1 балл;
- наличие солидного компонента - 1 балл;
- наличие метастазов - 1 балл;
- асцит - 1 балл.
U = 0 (при 0 баллов),
U = 1 (при 1 балле),
U = 3 (при баллах от 2 до 5).
| Пременопауза | Постменопауза |
|---|---|
| пи = -12,0 + 2,38 х LN [НЕ4] + 0,0626 х LN [СА125] | пи = -8,09 + 1,04 х LN [НЕ4] + 0,732 х LN [СА125] |
| Расчет индекса рома (%) | |
| roma = ехр (ПИ) / [1 + ехр (ПИ)] х 100 |
| Пременопауза | Постменопауза |
|---|---|
| меньше 7,39% - низкий риск эпителиального рака яичников | меньше 25,29% - низкий риск эпителиального рака яичников |
| больше 7,39% - высокий риск эпителиального рака яичников | больше 25,29% - высокий риск эпителиального рака яичников |


Приложение В
- Доброкачественные и злокачественные опухоли яичников встречаются в любом возрасте и характеризуются бессимптомным течением, что придает особую ценность ежегодному осмотру гинекологом и ежегодному ультразвуковому исследованию органов малого таза.
- Боли в нижних отделах живота и пояснице, увеличение живота, слабость, похудание являются поздними симптомами рака яичников.
- Опухоли яичников в 99,0% не приводят к нарушению менструального цикла.
- Эффективный скрининг раннего рака яичников отсутствует.
- Более 50% объемных образований придатков матки кистозного строения у менструирующих женщин являются функциональными, т.е. способными к самостоятельному регрессу. Подтверждение функционального характера кистозного образования яичников проводится при повторном ультразвуковом исследовании через 4-6 недель от первичного.
- У женщин постменопаузального периода (возрастное отсутствие менструаций) обнаружение кистозного образования яичников в подавляющем большинстве наблюдений является опухолью (доброкачественной или злокачественной). Окончательно судить о характере процесса возможно только после удаления опухоли, т.е. проведенного хирургического лечения.
- При посещении гинеколога необходимо подробно рассказать о всех кровных родственниках, страдавших злокачественной опухолью любой локализации как по женской, так и по мужской линии, особенно отмечая рак молочных желез, яичников, эндометрия, толстой кишки и желудка.
| 1. | Stewart B.W., Wild С.Р. World cancer report. Lyon: IARC, 2014. 916 p. |
|---|---|
| 2. | Kurman R.J., Cargangiu M.L., Herrington C.S. et al. IAR Lion 2014. WHO Classification of female reproductive organs]. |
| 3. | Франк Г.А., Москвина Л.B., Андреева Ю.Ю. Новая классификация опухолей яичника Журнал: Архив патологии. 2015; 77(4): 40-50. DOI: 10.17116/patol201577440-50 |
| 4. | Clark-Pearson D., Soper J. Gynecological Cancer Management. Identification, diagnosis and treatment. 2010. 196 p. |
| 5. | Нейштадт Э.Л., Ожиганова И.Н. Опухоли яичника. - СПб: ООО "Издательство ФОЛИАНТ", 2014. - 352 с.: ил. |
| 6. | Клиническая онкогинекология: в 3 т./под ред. Ф. Дж. Дисаи, У.Т. Крисмана; пер. с англ. под ред. Е.Г. Новиковой. - М.: Практическая медицина, 2012. - Т.3. - с.: ил. |
| 7. | Ribic-Pucelj М., Kobal В., et al. Surgical treatment of adnexal masses in pregnancy. J Reprod Med 2007; 52: 273-279. |
| 8. | Hess C.U., Peaseman A., O"Brier W.F. et al. Adnexal masses occurring with intrauterine pregnancy: report of 54 patients requiring laparotomy for mature management. Am J ObstatGynacol. 1988; 93: 585-589. |
| 9. | Graham L. ACOG Releases Guidelines on Management of Adnexal Masses. Am Fam Physician 2008; 77(9): 1320-3. |
| 10. | Management of Suspected Ovarian Masses in Premenopausal Women. RCOG/BSGE Joint Green-top Guideline No. 62, Nov 2011. |
| 11. | The Management of Ovarian Cysts in Postmenopausal Women. RCOG Green-top Guideline No. 34, July 2016. |
| 12. | Colombo N, Peiretti M, Garbi A, et al. Non-Epithelial Ovarian Cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012; 23 (7): vii20-6. |
| 13. | Peccatori FA, Azim HA Jr, Orecchia R, Hoekstra HJ, Pavlidis N, Kesic V, Pentheroudakis G. Cancer, pregnancy and fertility: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2013; 24(6): vii 160-70. |
| 14. | Guidelines for the Use of Laparoscopy for during Pregnancy. SAGES May 2017. |
| 15. | Prat J. Staging classification for cancer of the ovary, fallopian tube, and peritoneum. FIGO Committee on Gynecologic Oncology. Int J GynecolObstet 2014; 124(1): 1-5. |
| 16. | The Role of the Obstetrician-Gynecologist in the Early Detection of Epithelial Ovarian Cancer in Women at Average Risk. ACOG Committee Opinion. SGO No. 716, Nov 2017. |
| 17. | Ovarian Cancer Screening Tests: Safety Communication - FDA Recommends Against Use. U.S. FDA, Posted 09.07.2016. |
| 18. | Final Recommendation Statement: Ovarian Cancer: Screening. U.S. Preventive Services Task Force (USPSTF). December 2016. |
| 19. | Клинические рекомендации по диагностике и лечению больных раком яичников, маточной трубы или первичным раком брюшины. Ассоциация онкологов России, 2014. |
| 20. | ICD-Q International Classification of Diseases for Oncology. 3rd Edition. By Percy C. WHO 2000, 240 p. |
| 21. | Порядок оказания медицинской помощи по профилю "акушерство и гинекология" (за исключением использования вспомогательных репродуктивных технологий)", утвержденный приказом Минздрава России от 1 ноября 2012 г. N 572н (ред. от 12 января 2016 г.) и зарегистрированный в Минюсте России 2 апреля 2013 г. N 27960. |
| 22. | Karseladze AI. WHO histological classification of ovarian tumors. Geneva 1999. ArkhPatol 2005; 1:64. |
| 23. | Randall LM, Pothuri B, Swisher EM. Multi-disciplinary summit on genetics services for women with gynecologic cancers: A Society of Gynecologic Oncology White Paper. GynOncol 2017; 146: 217-24. |
| 24. | Rizzuto I, Behrens RF, Smith LA. Risk of ovarian cancer in women treated with ovarian stimulating drugs for infertility (Review). Cochrane Database Syst Rev 2013, Issue 8. |
| 25. | Bunyavejchevin S, Phupong V. Laparoscopic surgery for presumed benign ovarian tumor during pregnancy. Cochrane Database Syst Rev 2013, Jan 31(1). |
| 26. | Новикова Е.Г., Чиссов В.И., Чулкова O.B. и др. Органосохраняющее лечение в онкогинекологии, Москва, 2000, 108 с. |
| 27. | Gotlieb WH, Chetrit A, Menczer J, et al. Demographic and genetic characteristics of patients with borderline ovarian tumors as compared to early stage invasive ovarian cancer. GynecolOncol 2005; 97(3): 780. |
| 28. | Stiekema A, Boldingh QJ, Korse CM, et al. Serum human epididymal protein 4 (HE4) as biomarker for the differentiation between epithelial ovarian cancer and ovarian metastases of gastrointestinal origin. GynecolOncol 2015; 136(3): 562-6. |
| 29. | Moore RG, Miller MC, Eklund EE, Lu KH, Bast RC, Lambert-Messerlian G. Serum levels of the ovarian cancer biomarker HE4 are decreased in pregnancy and increase with age. Am J ObstetGynecol 2012; 206(4): 349. |
| 30. | Santotoribio JD, Garcia-de la Torre A, Canavate-Solano C, et al. Cancer antigens 19.9 and 125 as tumor markers in patients with mucinous ovarian tumors. Eur J GynaecolOncol 2016; 37(1): 26-9. |
| 31. | Клиническая онкогинекология. Руководство для врачей. Под ред. В.П. Козаченко, Москва, 2016, 250 стр. |
| 32. | Fagotti A, Perelli F, Pedone L, Scambia G. Current Recommendations for Minimally Invasive Surgical Staging in Ovarian Cancer. Curr Treat Options Oncol 2016; 17(1): 3. |
| 33. | Мартынов C.A., Хирургическая тактика при лечении беременных с опухолевидными образованиями и опухолями яичников//Дис. д.м.н. 2016, 165 с. |
| 34. | Recent Advances in Diagnosis and Management of Ovarian Cancer. Jensen, S.E., & S.A., F. (Ed.) - First Edition. U.S.A.: Springer. 2014. |
| 35. | Герфанова E.B., Ашрафян Л.А., Антонова И.Б., Алешикова О.И., Ивашина С.В. Опухоли женской репродуктивной системы. 2015. 1: 70-75. |
| 36. | Hart WR. Borderline epithelial tumors of the ovary. Mod Pathol 2005; 18 (Suppl2): S33-50. |
| 37. | Jones MB. Borderline ovarian tumors: current concepts for prognostic factors and clinical management. ClinObstetGvnecol 2006; 49:517. |
| 38. | McDonald JM. Modesitt SC. The incidental postmenopausal adnexal mass. ClinObstetGvnecol. 2006 Sep: 49(3): 506-16. |
| 39. | Hereditary breast and ovarian cancer syndrome. ACOG Practice Bulletin No. 103. ObstetGynecol 2009; 113: 957-66. |
| 40. | Morgan RJ, Armstrong DK, Alvarez RD, et al. Ovarian Cancer, Version 1.2016. NCCN Clinical practice guidelines in oncology. J Nat Comp Cancer Network 2016; 14(9): 1134-63. |
| 41. | Порядок проведения диспансеризации определенных групп взрослого населения в редакции приказа Минздрава России от 9 декабря 2016 г. N 946н "О внесении изменений в порядок проведения диспансеризации определенных групп взрослого населения, утвержденному приказом Минздрава России от 3 февраля 2015 г. N 36ан" |
| 42. | Kurman R.J. et al. Blaustein′s Pathology of the Female Genital Tract 6th edition. - Springer, 2011. |
| 43. | Акушерство. Национальное руководство. М.: ГЭОТАР-Медиа, 2015. - 1080 с. |
| 44. | Brown DL, Andreotti RF, Lee SI, et al. ACR appropriateness criteria ovarian cancer screening. Ultrasound Q. 2010; 26(4): 219-23. |
| 45. | Timmerman D, Van Calster B, Testa AC et al. Ovarian cancer prediction in adnexal masses using ultrasound-based logistic regression models: a temporal and external validation study by the IOTA group. Ultrasound ObstetGynecol 2010; 36: 226-234. |
| 46. | Timmerman DV, L.; Bourne, Т.Н.; Collins, W.P.; Verrelst H.; Vergote, I. Terms, definitions and measurements to describe the sonographic features of adnexal tumors: a consensus opinion from the International Ovarian Tumor Analysis (IOTA) group. UltrasondObstetGynecol 2000; 16: 500-505. |
| 47. | Jacobs I, Oram D, Fairbanks J et al. A risk of malignancy index incorporating СA 125, ultrasound and menopausal status for the accurate preoperative diagnosis of ovarian cancer. Br J ObstetGynaecol 1990; 97: 922-929. |
| 48. | Tingulstad S, Hagen B, Skjeldestad FE et al. The risk-of-malignancy index to evaluate potential ovarian cancers in local hospitals. ObstetGynecol 1999; 93: 448-452 |
| 49. | Yen and Jaffe"s reproductive endocrinology: physiology, pathophysiology, and clinical management/[edited by] Jerome F. Strauss III, Robert Barbieri. - 7thed. |
| 50. | Ovarian cancer: recognition and initial management. Clinical guideline. Published: 27 April 2011 nice.org.uk/guidance/cgl22 (https://www.nice.org.uk/terms-and-conditions#notice-ofrights). |
| 51. | British Gynaecological Cancer Society (BGCS) Epithelial Ovarian/Fallopian Tube/Primary Peritoneal Cancer Guidelines: Recommendations for Practice. 2017. P. 48. |
| 52. | Screening for Ovarian Cancer: US Preventive Services Task Force Recommendation Statement. US Preventive Services Task Force. Grossman DC, Curry SJ, Owens DK, Barry MJ, Davidson KW, Doubeni CA, Epling JW Jr, Kemper AR, Krist AH, Kurth AE, Landefeld CS, Mangione CM, Phipps MG, Silverstein M, Simon MA, Tseng CW. JAMA. 2018 Feb 13; 319(6): 588-594. |
| 53. | Screening for Ovarian Cancer. Jin J. JAMA. 2018 Feb 13; 319(6): 624. doi: 10.1001/jama.2017.22136. |
| 54. | Приказ Минздрава России от 10 мая 2017 N 203н "Об утверждении критериев оценки качества медицинской помощи" (зарегистрировано в Минюсте России 17 мая 2017 г. N 46740) |
СОГЛАСОВАНО:
|
Главный внештатный специалист Минздрава России по акушерству и гинекологии академик РАН, профессор |
Л.В. Адамян |
8 октября 2018 г.
Минздрав разработал клинические рекомендации по диагностике и лечению доброкачественных новообразований яичников с позиции профилактики рака, которые содержат:
- основные факторы риска и группы риска по раку яичников;
- методы диагностики;
- тактику лечения пациенток.