Информационное письмо Федеральной службы по надзору в сфере здравоохранения от 22 января 2016 г. N 01И-70/16 "О фальсифицированном медицинском изделии"
Федеральная служба по надзору в сфере здравоохранения информирует о выявлении в обращении фальсифицированных медицинских изделий:
- "High Glossy Printing Paper for SONY 110HG, 110 mm x 18 m" (далее - медицинское изделие N 1);
- "High Glossy Printing Paper for SONY 110HD, 110 mm x 20 m" (далее - медицинское изделие N 2);
сопровождаемых регистрационным удостоверением N ФСЗ 2011/11403 от 29.12.2011, срок действия не ограничен, на медицинское изделие "Бумага регистрирующая для аппаратов ЭКГ, ЭЭГ, КТГ, спироанализаторов, видеомониторов и другого медицинского оборудования", производства "ЧЕРАКАРТА С.п.А.", Италия (экспертное заключение ФГБУ "ВНИИИМТ" Росздравнадзора от 15.12.2015 N 13/ГЗ-15-531Э-027).
В приложении к письму приведены отличительные признаки фальсифицированной продукции.
Федеральная служба по надзору в сфере здравоохранения предлагает субъектам обращения медицинских изделий провести проверку наличия в обращении указанного медицинского изделия, в установленном порядке провести мероприятия по предотвращению обращения на территории Российской Федерации незарегистрированного медицинского изделия и о результатах проинформировать соответствующий территориальный орган Росздравнадзора.
Территориальным органам Росздравнадзора провести мероприятия в соответствии с порядком, предусмотренным Административным регламентом Федеральной службы по надзору в сфере здравоохранения по исполнению государственной функции по контролю за обращением медицинских изделий, утвержденным приказом Минздрава России от 05.04.2013 N 196н (регистрация Минюста России от 07.08.2013 N 29290).
Приложение: Сравнительная таблица на 1 л. в 1 экз.
| Руководитель | М.А. Мурашко |
Приложение
к информационному письму Федеральной службы
по надзору в сфере здравоохранения
от 22 января 2016 г. N 01И-70/16
|
N п/п |
Наименование показателя | Фальсифицированное медицинское изделие | Оригинальное медицинское изделие |
|---|---|---|---|
| 1. | Наименование медицинского изделия N 1 | Указано на индивидуальной упаковке: "High Glossy Printing Paper for SONY 110HG, 110 mm x 18 m". Указано на групповой упаковке: High Glossy Printing Paper for Imaging systems, 110HG, 110 mm x 18 m". | Бумага регистрирующая для аппаратов ЭКГ, ЭЭГ, КТГ, спироанализаторов, видеомониторов и другого медицинского оборудования |
| 2. | Наименование медицинского изделия N 2 | Указано на индивидуальной упаковке: "High Glossy Printing Paper for SONY 110HD, 110 mm x 20 m". Указано на групповой упаковке: High Glossy Printing Paper for Imaging systems, 110HG, 110 mm x 20 m". | Бумага регистрирующая для аппаратов ЭКГ, ЭЭГ, КТГ, спироанализаторов, видеомониторов и другого медицинского оборудования |
| 3. | Наименование производителя медицинского изделия N 1, N 2 | На индивидуальной упаковке: сведения отсутствуют. На групповой упаковке: сведения отсутствуют. | Via Secondo Casadei, 14 47122 Forli (PC), Italy |
| 4. | Размер изделия N 1 | Указано на индивидуальной и групповой упаковке: 110 mm x 18 m. |
Ширина бумаги: от 35 мм
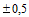 мм до 420 мм
мм до 420 мм  мм.
Длина бумаги: от 5 м
мм.
Длина бумаги: от 5 м  м до 520 м
м до 520 м 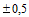 м.
м.
|
| 5. | Размер изделия N 2 | Указано на индивидуальной и групповой упаковке: 110 mm x 20 m. |
Ширина бумаги: от 35 мм
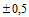 мм до 420 мм
мм до 420 мм 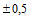 мм.
Длина бумаги: от 5 м
мм.
Длина бумаги: от 5 м 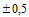 м до 520 м
м до 520 м 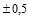 м.
м.
|
| 6. | Комплектность изделия N 1, N 2 | В индивидуальной упаковке по 1 шт. | В индивидуальной термоупаковке по 2-12 шт. |
Обзор документа
Сообщается о выявлении в обращении фальсифицированных медицинских изделий "High Glossy Printing Paper for SONY 110HG, 110 mm x 18 m", "High Glossy Printing Paper for SONY 110HD, 110 mm x 20 m". Указанные изделия сопровождаеются РУ N ФСЗ 2011/11403 от 29.12.2011, срок действия не ограничен.
Приведены отличительные признаки фальсифицированной продукции.
Субъектам обращения медицинской продукции следует проверить наличие в обращении указанных медизделий и предотвратить их обращение на территории России. О результатах проинформировать территориальный орган Росздравнадзора.



(1).jpg)


