Приказ Министерства сельского хозяйства РФ от 30 октября 2020 г. № 655 "Об утверждении Методики производства молекулярно-генетического исследования генно-инженерно-модифицированных микроорганизмов сельскохозяйственного назначения, используемых для разведения и (или) выращивания на территории Российской Федерации, Методики производства экспертиз (исследований) биологической безопасности генно-инженерно-модифицированных микроорганизмов сельскохозяйственного назначения, используемых для разведения и (или) выращивания на территории Российской Федерации" (документ не вступил в силу)
В соответствии с пунктом 13 Правил государственной регистрации генно-инженерно-модифицированных организмов, предназначенных для выпуска в окружающую среду, а также продукции, полученной с применением таких организмов или содержащей такие организмы, включая указанную продукцию, ввозимую на территорию Российской Федерации, утвержденных постановлением Правительства Российской Федерации от 23 сентября 2013 г. № 839 (Собрание законодательства Российской Федерации, 2013, № 39, ст. 4991), приказываю:
1. Утвердить:
Методику производства молекулярно-генетического исследования генно-инженерно-модифицированных микроорганизмов сельскохозяйственного назначения, используемых для разведения и (или) выращивания на территории Российской Федерации, согласно приложению № 1 к настоящему приказу;
Методику производства экспертиз (исследований) биологической безопасности генно-инженерно-модифицированных микроорганизмов сельскохозяйственного назначения, используемых для разведения и (или) выращивания на территории Российской Федерации, согласно приложению № 2 к настоящему приказу.
2. Настоящий приказ вступает в силу с 1 марта 2021 г. и действует до 1 марта 2027 г.
| Министр | Д.Н. Патрушев |
Зарегистрировано в Минюсте РФ 31 декабря 2020 г.
Регистрационный № 62016
Приложение № 1
к приказу Минсельхоза России
от 30 октября 2020 г. № 655
Методика
производства молекулярно-генетического исследования генно-инженерно-модифицированных микроорганизмов сельскохозяйственного назначения, используемых для разведения и (или) выращивания на территории Российской Федерации
1. Настоящая Методика устанавливает порядок проведения молекулярно-генетического исследования генно-инженерно-модифицированных микроорганизмов сельскохозяйственного назначения, используемых для разведения и (или) выращивания на территории Российской Федерации (далее - исследование, ГММ соответственно).
2. Исследование проводится организацией (испытательной лабораторией), аккредитованной в национальной системе аккредитации в области аккредитации, соответствующей исследованиям, указанным в настоящей Методике.
3. Результаты исследования оформляются заключением о результатах исследования, составляемым на основании протоколов испытаний, которое должно содержать следующие сведения:
наименование заключения;
полное наименование и адрес в пределах места нахождения организации (испытательной лаборатории), осуществившей проведение исследования;
наименование ГММ с указанием его таксономического статуса;
полное наименование, адрес в пределах места нахождения, идентификационный номер налогоплательщика юридического лица, осуществляющего на территории Российской Федерации генно-инженерную деятельность в целях создания ГММ (далее - заявитель);
полное наименование и адрес в пределах места нахождения юридического лица либо фамилия, имя, отчество (при наличии), адрес места жительства индивидуального предпринимателя - изготовителя образцов ГММ, представленных для проведения исследования;
вид предполагаемого целевого использования ГММ;
сведения о трансформационном событии в виде кода, сформированного согласно Общероссийскому классификатору трансформационных событий;
место депонирования и коллекционный номер штамма ГММ (указывается для депонированных ГММ);
регистрационный номер свидетельства о государственной регистрации ГММ, предназначенного (предназначенных) для выпуска в окружающую среду, на основе которого (которых) создан ГММ, в отношении которого проведено исследование (в случае если ГММ создан на основе иного (иных) ГММ);
регистрационный номер свидетельства о государственной регистрации ГММ для иного целевого использования (при наличии);
сведения о регистрации ГММ за рубежом (при наличии);
оценка полноты представленных заявителем документов и данных;
краткое содержание документов и данных, представленных заявителем для проведения исследования;
описание представленных заявителем для проведения исследования образцов ГММ и исходного микроорганизма-реципиента с указанием их количества, а также оценка их пригодности для проведения исследования;
перечень исследований ГММ с указанием их результатов;
выводы о результатах исследования: о молекулярно-генетической структуре ГММ, об отсутствии или наличии незаявленных генетических конструкций; об эффективности метода идентификации ГММ; сведения о соответствии генетической модификации природным (естественным) процессам;
фамилии, имена, отчества (при наличии) лиц, проводивших исследование, ученые степени, ученые звания (при наличии), места их работы и должности;
дата и номер заключения исследования;
подпись руководителя организации (испытательной лаборатории), осуществившей проведение исследования.
4. К заключению о результатах исследования ГММ должны прилагаться протоколы испытаний, на основании которых оно составлено, подписанные лицами, проводившими исследования.
5. В случае если заявителем не представлены документы и данные, предусмотренные пунктом 6 настоящей Методики, и (или) необходимые образцы, пригодные для проведения исследований, исследование не проводится. Заявителю должен быть выдан мотивированный отказ в проведении исследования, подписанный руководителем организации (испытательной лаборатории), аккредитованной в национальной системе аккредитации в области аккредитации, соответствующей исследованиям, указанным в настоящей Методике, в которую обратился заявитель для проведения исследования.
6. В рамках исследования осуществляется рассмотрение представленных заявителем документов и данных:
а) наименования ГММ с указанием его таксономического статуса; полного наименования и адреса в пределах места нахождения, идентификационного номера налогоплательщика заявителя; полного наименования и адреса в пределах места нахождения юридического лица либо фамилии, имени, отчества (при наличии), адреса места жительства индивидуального предпринимателя - изготовителя образцов ГММ, предоставленных на исследование; вида предполагаемого целевого использования ГММ; регистрационного номера свидетельства о государственной регистрации ГММ, предназначенного (предназначенных) для выпуска в окружающую среду, на основе которого (которых) создан ГММ, в отношении которого проводится исследование (в случае если ГММ создан на основе иного (иных) ГММ); регистрационного номера свидетельства о государственной регистрации ГММ для иного целевого использования (при наличии) либо информации об отсутствии такого свидетельства;
б) сведений об исходном микроорганизме-реципиенте (таксономическая характеристика с указанием метода идентификации; источник выделения штамма: субстрат, географический пункт, дата выделения; методы идентификации штамма, кем идентифицирован (фамилия, имя, отчество (при наличии), ссылка на использованные определители);
в) сведений о трансформационном событии в виде кода, сформированного согласно Общероссийскому классификатору трансформационных событий;
г) информации о месте депонирования и коллекционном номере штамма ГММ, паспорта штамма ГММ (для депонированных штаммов ГММ) либо следующей информации (в случае непредставления информации о месте депонирования и коллекционном номере штамма ГММ, паспорта штамма ГММ):
о культурально-морфологических, физиолого-биохимических (ферментативных), антигенных, биологических свойствах и генетических особенностях штамма ГММ;
об условиях культивирования: наименованиях питательных сред, рН среды, температуре и продолжительности выращивания, сроке хранения и периодичности пересева культуры штамма ГММ в нативной форме;
о применяемом способе и условиях хранения штамма ГММ: в случае лиофилизации указываются продолжительность выращивания на питательной среде (возраст культуры), состав защитной среды, титр клеточной суспензии, режим высушивания, температура хранения, срок хранения; в случае криоконсервации указываются продолжительность выращивания на питательной среде (возраст культуры), состав защитной среды, титр клеточной суспензии, скорость замораживания (град/мин), температура хранения, срок хранения;
о диссоциации культуры в зависимости от метода хранения (описание морфологических типов колоний на конкретной среде с подробным описанием типа, сохраняющего полезный или диагностический признак);
о среде, на которой заявителем предоставляется штамм ГММ;
о количестве, дате приготовления и сроке годности образцов штамма ГММ;
д) описания структуры генетической конструкции (внесенной или удаленной) и места ее локализации, характеристики экспрессии встроенных или измененных генов;
е) информации о генетической модификации (описание метода модификации, структуры вектора, структуры вставки);
ж) информации об организмах - донорах вносимых генов (с указанием группы патогенности при наличии);
з) описания методики, позволяющей идентифицировать генетическую модификацию с описанием нуклеотидных последовательностей, используемых праймеров, зондов и условий полимеразной цепной реакции (далее - ПЦР);
и) информации о регистрации ГММ за рубежом (при наличии);
к) данных полногеномного секвенирования ГММ (при наличии).
Заявителем для исследования предоставляются образцы ГММ и исходного микроорганизма-реципиента.
7. В рамках исследования должны быть проведены следующие испытания представленных заявителем образцов ГММ и исходного микроорганизма-реципиента:
а) проверка (валидация) методики идентификации ГММ, в том числе оценка чувствительности и специфичности данной методики в соответствии с критериями эффективности, указанными в таблице № 1 приложения к настоящей Методике;
б) подтверждение присутствия (отсутствия) заявленной генетической модификации в геноме ГММ;
в) полногеномное секвенирование ГММ (в случае непредставления заявителем данных полногеномного секвенирования ГММ, проведенного с использованием методики полногеномного секвенирования, соответствующей критериям эффективности, указанным в таблице № 2 приложения к настоящей Методике).
8. Полногеномное секвенирование ГММ проводится с использованием методики полногеномного секвенирования, соответствующей критериям эффективности, указанным в таблице № 2 приложения к настоящей Методике.
Приложение
к Методике производства
молекулярно-генетического
исследования генно-
инженерно-модифицированных
микроорганизмов
сельскохозяйственного
назначения, используемых для
разведения и (или)
выращивания на территории
Российской Федерации,
утвержденной приказом
Минсельхоза России
от 30 октября 2020 г. № 655
Таблица № 1. Критерии эффективности методики идентификации ГММ
| № | Характеристика | Описание характеристики | Критерий | Методы оценки критерия |
|---|---|---|---|---|
| 1 | Специфичность ПЦР | Способность ПЦР-тест-системы выявлять только целевую ДНК. | ПЦР-тест-система должна выявлять целевую ДНК. ПЦР-тест-система не должна давать ложноположительных результатов, в том числе выявлять ДНК близкородственных и неродственных биологических видов в 100% проводимых исследований. | Для оценки специфичности используются контрольные панели образцов. В состав панели должны входить образцы, содержащие целевую ДНК и не содержащие целевую ДНК. |
| 2 | Чувствительность ПЦР | Наименьшее содержание копий целевой ДНК, которое может быть определено с использованием ПЦР-методики, в зависимости от свойств используемых праймеров и зондов | Чувствительность должна быть не ниже 100 копий целевой плазмидной ДНК в одной ПЦР | Проводятся исследования ряда десятикратных разведений целевой плазмидной ДНК с известной концентрацией в двух повторах каждое. Определяется максимальное разведение, при котором ДНК воспроизводимо выявляется (в двух повторах) |
| 3 | Эффективность ПЦР | Прирост матрицы на каждом цикле амплификации. | Эффективность ПЦР должна быть не ниже 90%. Это соответствует значению наклона линейной области зависимости Ct от логарифма концентрации ДНК матрицы (slope): не ниже - 3,6 (приемлем диапазон slope 3,1 - 3,6) | Для оценки эффективности ПЦР проводится амплификация с рядом десятикратных разведений целевой плазмидной ДНК (пункт 2 настоящей таблицы) в двух повторах каждое. По результатам амплификации строится график зависимости Ct от логарифма концентрации ДНК матрицы. Определяется наклон линейной области (slope). Эффективность ПЦР оценивается по уравнению: Е = [10 (-1 / slope)] -1, в идеальном случае - при удвоении количества ПЦР продукта за один цикл: Е= 100%, (slope = -3,32) |
| 4 | Предел обнаружения ПЦР-тест-системы (LOD) | Минимальное количество биологического искомого объекта в исследуемом образце, которое может достоверно обнаружить данный метод | Чем меньше искомого биологического объекта способен выявить метод, тем выше его чувствительность. Предел обнаружения ПЦР-тест-системы (LOD) должен составлять не более 0,1% | Готовится ряд модельных образцов с разным содержанием целевой матрицы. Готовятся образцы целевого ГММ ингредиента (от 5 до 0,001% содержания) в соответствующей матрице. Приготовленная панель исследуется с использованием ПЦР-методики. Определяется минимальное содержание ГММ-ингредиента в тотальной ДНК организма, при котором ГММ воспроизводимо выявляется (в десяти повторах) |
| 5 | Предел количественного определения (LOQ) | Наименьшее количество (концентрация) вещества в образце, которое может быть количественно оценено с использованием методики с требуемой правильностью и внутрилабораторной прецизионностью | Предел количественного определения (LOQ) должен быть не более 0,1%. На пределе чувствительности относительное стандартное отклонение (RSD) не должно превышать 20%. Истинное значение измеряемой величины должно входить в полученный при измерениях доверительный интервал | Исследуются 10 повторов 0,1% ГММ-стандарта по ГЦР-методике. Рассчитывается среднее значение содержания ГММ в образце и относительное стандартное отклонение (RSD). Рассчитанное стандартное отклонение (RSD) сравнивается с критерием 20%. Также оценивается, входит ли истинное значение в доверительный интервал полученного среднего значения |
| 6 | Аналитическая область | Интервал определяемых аналитических характеристик, в котором получаемые результаты имеют приемлемый уровень правильности и прецизионности, приемлем диапазон 0,1 - 5% | Диапазон 0,1 - 5% ГММ экспериментальных данных должен удовлетворять линейной модели (пункт 7 настоящей таблицы) | Проводятся исследования образцов с различным содержанием ГММ. Оценивается линейность зависимости аналитического сигнала |
| 7 | Линейность | Наличие линейной зависимости аналитического сигнала в анализируемой пробе в пределах аналитической области методики. Оценивается как коэффициент корреляции R2, определяющий верность модели линейной зависимости Ct от логарифма концентрации калибровочных образцов | Коэффициент R2 для калибровочных образцов должен быть не менее 0,98% | Исследуются в двух повторах 0,1%, 1,0% и 5% калибровочные ГММ-стандарты по ПЦР-методике. Строится калибровочная прямая (dCt от lgC), оценивается коэффициент корреляции данных с линейной зависимостью (R2) |
| 8 | Правильность | Отклонение среднего результата определений, выполненных с использованием методики, от значения, принимаемого за истинное | Методика дает корректные результаты, если значения, принимаемые за истинные, лежат внутри доверительных интервалов соответствующих средних результатов анализов, полученных экспериментально по данной методике | Готовятся образцы из калибровочных ГММ-стандартов 0,1%, 1,0% и 5% с добавлением матриц различного происхождения путем смешивания указанных стандартов с другими ингредиентами (сухим молоком, мясным фаршем, рыбной мукой). Образцы исследуются по ПЦР-методике в двух повторах. Оценивается, входит ли истинное значение в диапазон погрешности полученного среднего значения для каждого образца |
Таблица № 2. Критерии эффективности методики полногеномного секвенирования
| Этап анализа | Характеристика | Описание характеристики | Критерий |
|---|---|---|---|
| Подготовка библиотеки для секвенирования | Концентрация геномной ДНК | Не менее 0,2 нг/мкл | |
| Размер фрагментов ДНК | Распределение фрагментов по длинам устанавливается электрофоретически | Распределение в диапазоне 250 - 1000 п.н. Максимум распределения - 300 - 500 п.н. | |
| Проведение массового параллельного секвенирования | Распределение качества идентификации нуклеотидов | Q=-10 log10p, где р - вероятность неправильного определения нуклеотида | Q>20, то есть вероятность ошибки не более 0,01 |
| Среднее качество прочтения | Q>25 | ||
| Служебные последовательности | Наличие служебных последовательностей (адаптеров, индексов) в прочтении | Должны отсутствовать | |
| Покрытие чтения | Число чтений, содержащих определенный нуклеотид последовательности генома | Не менее десятикратного покрытия | |
| Представленность нуклеотидов в каждом цикле | Максимальное отклонение между А и Т или G и С | Не более 20% в любой позиции | |
| GC-состав на прочтение | Сумма отклонений от ожидаемого распределения | Не более 30% прочтений |
Приложение № 2
к приказу Минсельхоза России
от 30 октября 2020 г. № 655
Методика
производства экспертиз (исследований) биологической безопасности генно-инженерно-модифицированных микроорганизмов сельскохозяйственного назначения, используемых для разведения и (или) выращивания на территории Российской Федерации
I. Общие положения
1. Настоящая Методика устанавливает порядок производства экспертиз (исследований) биологической безопасности генно-инженерно-модифицированных микроорганизмов сельскохозяйственного назначения, используемых для разведения и (или) выращивания на территории Российской Федерации (далее - экспертиза, ГММ соответственно).
2. Экспертиза проводится организацией (испытательной лабораторией), аккредитованной в национальной системе аккредитации в области аккредитации, соответствующей исследованиям, указанным в настоящей Методике.
3. Результаты экспертизы оформляются заключением о результатах экспертизы, составленным на основании протоколов исследований ГММ, которое должно содержать следующие сведения:
наименование заключения;
полное наименование и адрес в пределах места нахождения организации (испытательной лаборатории), осуществившей проведение экспертизы;
наименование ГММ с указанием его таксономического статуса;
полное наименование, адрес в пределах места нахождения, идентификационный номер налогоплательщика юридического лица, осуществляющего на территории Российской Федерации генно-инженерную деятельность в целях создания ГММ (далее - заявитель);
полное наименование и адрес в пределах места нахождения юридического лица либо фамилия, имя, отчество (при наличии), адрес места жительства индивидуального предпринимателя - изготовителя образцов ГММ, представленных на экспертизу;
вид предполагаемого целевого использования ГММ;
сведения о трансформационном событии в виде кода, сформированного согласно Общероссийскому классификатору трансформационных событий;
место депонирования и коллекционный номер штамма ГММ (указывается для депонированных ГММ);
регистрационный номер свидетельства о государственной регистрации ГММ, предназначенного (предназначенных) для выпуска в окружающую среду, на основе которого (которых) создан ГММ, в отношении которого проведена экспертиза (в случае если ГММ создан на основе иного (иных) ГММ);
регистрационный номер свидетельства о государственной регистрации ГММ для иного целевого использования (при наличии);
сведения о регистрации ГММ за рубежом (при наличии);
оценка полноты представленных заявителем документов и данных;
краткое содержание документов и данных, представленных заявителем для проведения экспертизы;
перечень исследований ГММ с указанием их результатов;
описание представленных заявителем на экспертизу образцов ГММ и исходного микроорганизма-реципиента с указанием их количества, а также оценка их пригодности для проведения исследований;
выводы о результатах экспертизы: о наличии или отсутствии негативного воздействия ГММ на окружающую среду;
специальные условия использования ГММ (при наличии);
срок действия свидетельства о государственной регистрации ГММ (в случае отсутствия сведений о негативном воздействии ГММ на окружающую среду);
фамилии, имена, отчества (при наличии) лиц, проводивших экспертизу, ученые степени, ученые звания (при наличии), места их работы и должности;
дата и номер заключения экспертизы;
подпись руководителя организации (испытательной лаборатории), осуществившей проведение экспертизы.
4. К заключению о результатах экспертизы должны прилагаться протоколы исследований ГММ, на основании которых оно составлено, подписанные лицами, проводившими исследования.
5. В случае если заявителем не представлены документы и данные, предусмотренные пунктом 6 настоящей Методики, и (или) необходимые образцы, пригодные для проведения исследований, экспертиза не проводится. Заявителю должен быть выдан мотивированный отказ в проведении экспертизы, подписанный руководителем организации (испытательной лаборатории), аккредитованной в национальной системе аккредитации в области аккредитации, соответствующей исследованиям, указанным в настоящей Методике, в которую обратился заявитель для проведения экспертизы.
II. Экспертиза ГММ
6. В рамках экспертизы ГММ осуществляется рассмотрение представленных заявителем документов и данных:
а) наименования ГММ с указанием его таксономического статуса; полного наименования, адреса в пределах места нахождения, идентификационного номера налогоплательщика заявителя; полного наименования и адреса в пределах места нахождения юридического лица, фамилии, имени, отчества (при наличии), адреса места жительства индивидуального предпринимателя - изготовителя образцов ГММ, предоставленных на экспертизу; вида предполагаемого целевого использования ГММ; регистрационного номера свидетельства о государственной регистрации ГММ, предназначенного (предназначенных) для выпуска в окружающую среду, на основе которого (которых) создан ГММ, в отношении которого проводится экспертиза (в случае если ГММ создан на основе иного (иных) ГММ); регистрационного номера свидетельства о государственной регистрации ГММ для иного целевого использования (при наличии) либо информации об отсутствии такого свидетельства;
б) сведений об исходном микроорганизме-реципиенте (таксономическая характеристика с указанием метода идентификации; источник выделения штамма: субстрат, географический пункт, дата выделения; методы идентификации штамма, кем идентифицирован (фамилия, имя, отчество (при наличии), ссылка на использованные определители);
в) описания структуры генетической конструкции (внесенной или удаленной) и места ее локализации, характеристики экспрессии встроенных или измененных генов;
г) сведений о трансформационном событии в виде кода, сформированного согласно Общероссийскому классификатору трансформационных событий;
д) информации о генетической модификации (описание метода модификации, структуры вектора, структуры вставки);
е) информации о месте депонирования и коллекционном номере штамма ГММ, паспорта штамма ГММ (для депонированных штаммов ГММ) либо следующей информации (в случае непредставления информации о месте депонирования и коллекционном номере штамма ГММ, паспорта штамма ГММ):
о культурально-морфологических, физиолого-биохимических (ферментативных), антигенных, биологических свойствах и генетических особенностях штамма ГММ;
об условиях культивирования: наименованиях питательных сред, рН среды, температуре и продолжительности выращивания, сроке хранения и периодичности пересева культуры штамма ГММ в нативной форме;
о применяемом способе и условиях хранения штамма ГММ: в случае лиофилизации указываются продолжительность выращивания на питательной среде (возраст культуры), состав защитной среды, титр клеточной суспензии, режим высушивания, температура хранения, срок хранения; в случае криоконсервации указываются продолжительность выращивания на питательной среде (возраст культуры), состав защитной среды, титр клеточной суспензии, скорость замораживания (град/мин), температура хранения, срок хранения;
о диссоциации культуры в зависимости от метода хранения (описание морфологических типов колоний на конкретной среде с подробным описанием типа, сохраняющего полезный или диагностический признак);
о среде, на которой заявителем предоставляется штамм ГММ;
о количестве, дате приготовления и сроке годности образцов штамма ГММ;
ж) информации о вносимых генах (для организмов-доноров указывается таксономический статус, данные о вирулентных, аллергенных и патогенных свойствах);
з) описания свойств, приобретенных ГММ в результате модификации;
и) характеристики различий ГММ с исходным микроорганизмом-реципиентом, в том числе описания способа размножения, распространения, вирулентности, схемы культивирования, новых фенотипических свойств, биологических преимуществ ГММ по сравнению с исходным микроорганизмом-реципиентом;
к) описания методики, позволяющей подтвердить таксономический статус ГММ, описания нуклеотидных последовательностей, используемых праймеров, зондов, условий проведения полимеразной цепной реакции;
л) результатов изучения стабильности ГММ, в том числе в организмах животных (крыс или мышей), а также оценки способности к переносу генов, введенных в исходный микроорганизм-реципиент с использованием методов генной инженерии в другие микроорганизмы;
м) информации о регистрации ГММ в государствах - членах Евразийского экономического союза, иных государствах или об отсутствии такой регистрации, а также о наличии либо отсутствии фактов негативных последствий применения ГММ;
н) копии заключения о результатах молекулярно-генетического исследования ГММ;
о) информации о биоинформатическом анализе, поиске гомологии рекомбинантного белка с аминокислотными последовательностями токсических белков, белков, обладающих фармакологической или иной биологической активностью, при использовании специализированных баз данных;
п) протоколов исследований, указанных в пункте 7 настоящей Методики, проведенных в организациях (испытательных лабораториях), аккредитованных в национальной системе аккредитации в области аккредитации, соответствующей исследованиям, указанным в настоящей Методике (при наличии).
7. В отношении ГММ должны быть проведены следующие исследования в сравнении с исходным микроорганизмом-реципиентом:
а) исследование вирулентности ГММ на лабораторных животных;
б) токсикологические исследования на лабораторных животных;
в) исследования стабильности свойств ГММ;
г) исследование жизнестойкости ГММ на объектах окружающей среды, в том числе на влажных опилках, ватных тампонах, при термической обработке.
8. В случае отсутствия у заявителя протоколов исследований, указанных в подпункте "п" пункта 6 настоящей Методики, им должны быть представлены образцы ГММ и исходного микроорганизма-реципиента. Соответствующие исследования этих образцов проводятся организацией (испытательной лабораторией), осуществляющей проведение экспертизы.
9. Если ГММ соответствует показателям (условиям) безопасности, указанным в пункте 10 настоящей Методики, заявителю должно быть выдано заключение об отсутствии негативного воздействия ГММ на окружающую среду. В заключении об отсутствии негативного воздействия на окружающую среду могут быть указаны специальные условия использования ГММ.
10. Требования к проведению исследований и показатели (условия) безопасности ГММ:
а) исследования вирулентности ГММ на лабораторных животных должны проводиться на свободных от специфических патогенов мышах или цыплятах с определением летальной дозы для 50% лабораторных животных (далее - ЛД50) в течение 10 календарных дней при соотношении самцов и самок 1:1. Животные должны быть разделены на 2 равные группы: группа "контроль" и группа "опыт". Определение ЛД50 проводится путем внутрибрюшинного введения животным группы "опыт" по 0,1 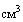 живой суточной культуры исследуемого штамма в концентрации 1x10(9), 1x10(7), 1x10(5) и 1x10(3)
живой суточной культуры исследуемого штамма в концентрации 1x10(9), 1x10(7), 1x10(5) и 1x10(3) 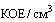 . Животным группы "контроль" внутрибрюшинно вводится стерильный физиологический раствор или стерильная среда для культивирования исследуемого штамма ГММ.
. Животным группы "контроль" внутрибрюшинно вводится стерильный физиологический раствор или стерильная среда для культивирования исследуемого штамма ГММ.
Обе группы животных должны получать одинаковый по объему и составу рацион. Животные должны иметь доступ к корму и воде, содержаться в помещении с системой отопления и регулируемым микроклиматом.
По завершении эксперимента необходимо подсчитать гибель животных в каждой группе и определить ЛД50. Если ЛД50 равна 5x10(8) 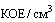 и более, штамм считают авирулентным. ЛД50 для штамма ГММ не должна быть меньше ЛД50 исходного микроорганизма-реципиента;
и более, штамм считают авирулентным. ЛД50 для штамма ГММ не должна быть меньше ЛД50 исходного микроорганизма-реципиента;
б) токсикологические исследования на лабораторных животных должны проводиться на крысах или мышах (в зависимости от вида животных, сведения о которых представлены заявителем в соответствии с пунктом 6 настоящей Методики) в течение 90 календарных дней при соотношении самцов и самок 1:1. Животные должны быть разделены на 2 равные группы: группа "контроль" и группа "опыт". Группа "контроль" должна получать рацион с включением исходного микроорганизма-реципиента; группа "опыт" должна получать рацион с включением исследуемого ГММ. Обе группы животных должны получать одинаковый по объему и составу рацион, за исключением включенного исследуемого ГММ или исходного микроорганизма-реципиента. Исследуемый ГММ и исходный микроорганизм-реципиент должны быть включены в состав корма в равном количестве. Животные должны иметь доступ к корму и воде, содержаться в помещении с системой отопления и регулируемым микроклиматом.
Должны исследоваться следующие показатели состояния животных:
персистенция и выделение ГММ из организма животных;
общее состояние животных: внешний вид, двигательная активность, состояние шерстного покрова - каждые 2 календарных дня; поедаемость корма - ежедневно; масса тела - каждые 7 календарных дней;
гематологические показатели крови: концентрация гемоглобина; гематокрит; общее количество эритроцитов; средний объем эритроцита (СОЭ); среднее содержание гемоглобина в эритроците (ССЭ); средняя концентрация гемоглобина в эритроците (СКЭ); общее количество тромбоцитов; общее количество лейкоцитов; дифференцированный подсчет лейкоцитов (нейтрофилы, лимфоциты, эозинофилы, моноциты, базофилы);
биохимические показатели крови: аланинаминотрансфераза (АЛТ); аспартатаминотрансфераза (ACT); желчные кислоты; фосфатаза щелочная; билирубин общий; билирубин прямой; белок общий; альбумин; глобулин; креатинин; глюкоза; альфа-амилаза; липаза; лактатдегидрогеназа; общие липиды; триглицериды; холестерин; холинэстераза; мочевина; хлориды; натрий; фосфор; калий;
общий анализ мочи: цвет и прозрачность; относительная плотность; рН; белок; глюкоза; креатинин.
Исследования гематологических и биохимических показателей крови, персистенции и показателей мочи должны проводиться на 90-й календарный день опыта у 50% животных из каждой группы. По окончании восстановительного периода (10-й календарный день со дня окончания дачи рациона с ГММ, 101-й календарный день опыта) должны проводиться те же исследования у второй половины животных каждой группы.
Скармливание животным рациона, содержащего ГММ, не должно вызывать клинических изменений (показатели крови, мочи, общего состояния животных группы "опыт", персистенции и выделения ГММ не должны отклоняться от показателей группы "контроль"), не должны выявляться патологоанатомические изменения при вскрытии;
в) стабильность свойств ГММ должна проверяться при пассировании исследуемых штаммов на жидких и плотных питательных средах с тестированием фенотипических (биохимических) свойств через 6 последовательных пассажей. Молекулярно-генетическими методами должен исследоваться исходный ГММ и ГММ после шестикратного пассирования. Стабильными являются штаммы ГММ, не изменившие фенотипических (биохимических) свойств и сохранившие генетическую структуру после проведения шестикратного пассирования. ГММ должны демонстрировать стабильность фенотипических (биохимических) свойств и генетической структуры;
г) исследование жизнестойкости ГММ на объектах окружающей среды, в том числе на влажных опилках, ватных тампонах, при термической обработке должно проводиться с использованием питательных сред, культур клеток или иных тест-объектов, чувствительных к исходному микроорганизму-реципиенту, согласно информации, представленной заявителем в соответствии с пунктом 6 настоящей Методики. Эксперименты должны проводиться с использованием в качестве контроля исходного микроорганизма-реципиента. Условия экспериментов для исходного микроорганизма-реципиента и ГММ должны совпадать. Жизнестойкость ГММ в окружающей среде не должна превышать жизнестойкость исходного микроорганизма-реципиента.
Обзор документа
Утвержден порядок проведения молекулярно-генетического исследования и экспертиз биологической безопасности генно-инженерно-модифицированных микроорганизмов (ГММ) сельхозназначения для разведения и выращивания в России.
Исследование (экспертиза) проводится аккредитованной испытательной лабораторией. Результаты оформляются заключением, составляемым на основании протоколов испытаний (исследований). В рамках исследования должны быть проведены:
- проверка (валидация) методики идентификации ГММ;
- подтверждение заявленной генетической модификации в геноме ГММ;
- полногеномное секвенирование ГММ.
Приказ вступает в силу с 1 марта 2021 г. и действует до 1 марта 2027 г.



(1).jpg)


